肝脏自噬:代谢稳态与疾病治疗的潜在关键
肝脏是一个高度动态的代谢器官,在血浆蛋白合成、糖异生和糖原储存、胆固醇代谢和胆汁酸合成以及药物代谢和解毒中起关键作用。过去几十年的研究表明,自噬是由溶酶体介导的细胞分解代谢过程,在维持肝脏中的细胞和代谢稳态方面起着重要作用。肝脏自噬随激素信号和营养物质的可用性而波动,这些营养物质对进食和禁食状态以及昼夜节律活动有反应。肝实质和非实质细胞中的自噬功能障碍可导致各种肝脏疾病,包括非酒精性脂肪肝(NAFLD)、酒精相关肝病、药物性肝损伤、胆汁淤积、病毒性肝炎和肝细胞癌。因此,靶向自噬可能是治疗这些不同肝脏疾病的潜在策略。
1. 阻塞性睡眠呼吸暂停综合征通过选择性自噬介导的Eepd1降解加剧NASH进展
以慢性间歇性缺氧(CIH)为特征的阻塞性睡眠呼吸暂停综合征(OSAS)是加重非酒精性脂肪性肝炎(NASH)的独立危险因素。上海交通大学医学院附属上海第六人民医院内分泌代谢科Junli Liu团队对CIH暴露和常氧暴露的小鼠进行了配对喂养研究[1]。研究表明,CIH暴露会加重DNA损伤,导致肝纤维化和炎症。全基因组关联研究(GWAS)数据分析还揭示了DNA修复酶Eepd1与OSAS之间的关联。此外,研究发现CIH触发选择性自噬,导致Eepd1自噬降解,从而加剧肝细胞中的DNA损伤(图1)。值得注意的是,Eepd1肝脏特异性敲除小鼠表现出加重的肝脏DNA损伤和NASH的进一步进展。为了确定CIH诱导的NASH的治疗方法,进行了药物筛选,发现瑞替加滨抑制CIH介导的Eepd1降解,从而减轻肝细胞中的DNA损伤。这些发现意味着靶向CIH介导的Eepd1降解可以成为治疗因OSAS而加剧的NASH的辅助方法。
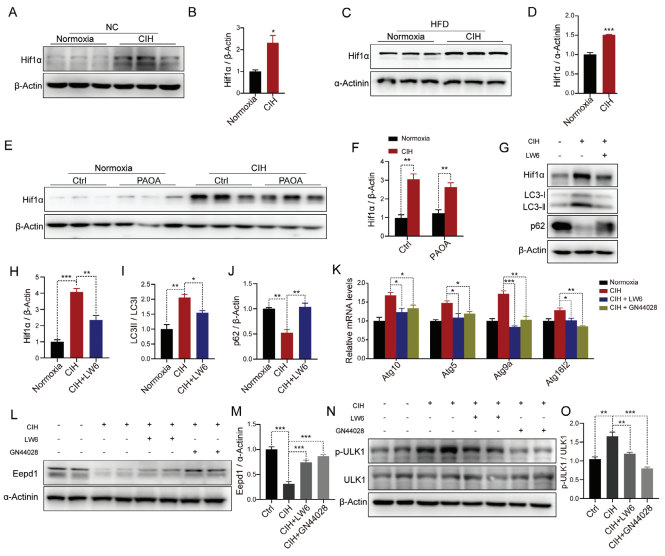
图1 CIH在体内和体外通过Hif1α促进自噬
2. NDP52通过Rab9依赖性溶酶体降解途径介导对乙型肝炎病毒感染的抗病毒反应
自噬受体NDP52触发细菌对感染的自噬。然而,NDP52预防病毒感染的能力尚未确定。上海中国科学院Yu Wei团队发现NDP52与乙型肝炎病毒(HBV)的包膜蛋白结合,并引发促进HBV清除的降解过程[2]。肝细胞中NDP52的失活导致溶酶体中病毒包膜的靶向性降低,病毒复制水平升高。NDP52在病毒进入和复制后期都能抑制HBV。与NDP52介导的细菌自噬相反,HBV包膜的溶酶体降解与GAL8和ATG5无关。NDP52与Rab9和病毒包膜蛋白形成复合物,并将HBV与Rab9依赖的溶酶体降解途径联系起来(图2)。这些发现表明,NDP52作为HBV感染的传感器,介导了一种独特的抗病毒反应来消除病毒。
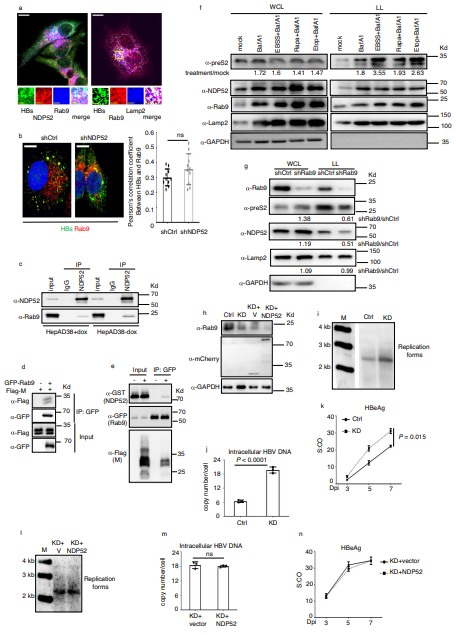
图2 Rab9参与NDP52介导的病毒降解
3. CHIP通过促进K63和k27相关的STX17泛素化促进自噬体-溶酶体融合改善NAFLD
自噬体和溶酶体的融合对于预防NAFLD至关重要。韩国延世大学生命科学与技术学院生物化学系Jaewhan Song团队建立了一种肝细胞特异性CHIP敲除(H-KO)小鼠模型,该模型在高脂肪饮食(HFD)或高脂肪、高果糖饮食(HFHFD)的反应下更快地发展为NAFLD[3]。H-KO小鼠和CHIP耗竭细胞肝脏中P62和LC3的积累表明自噬体-溶酶体融合受到抑制。AAV8介导的小鼠肝脏中CHIP的过表达减缓了HFD或HFHFD喂养诱导的NAFLD的进展(图3)。从机制上讲,CHIP诱导STX17赖氨酸198残基的K63和K27连接的多泛素化,导致STX17-SNAP29-VAMP8复合物形成增加。STX17 K198R突变体未被CHIP泛素化;它干扰了其与VAMP8的相互作用,使STX17无法抑制小鼠脂肪变性的发展。这些结果表明,涉及CHIP介导的STX17非降解泛素化的信号调节机制对于自噬体-溶酶体融合是必要的。

图3 AAV8介导的肝脏CHIP过表达抑制HFD或HFHFD引起的NAFLD进展
云克隆不仅可提供多种肝脏疾病动物模型,包括肝纤维化、肝缺血、酒精性肝病、肝内胆汁淤积、肝硬化、脂肪肝、肝功能衰竭等,涵盖常见肝脏疾病。还具有还具有多个物种肝星形细胞、肝窦内皮细胞、肝巨噬细胞、肝间充质干细胞等原代细胞产品和肝脏疾病常用检测指标及上述Hif1α、GAL8、ATG5等相关产品,可助力广大科研工作者进行肝脏疾病与自噬研究。
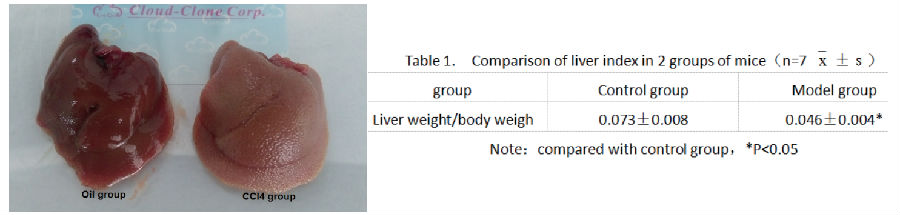
肝纤维化(HF)小鼠模型
建模方法:
按5ml/kg体重皮下注射体积分数为20%CCl4的油剂溶液(CCl4:橄榄油 =1:4), 每3天1次,连续6周。对照组动物皮下注射等量等次的橄榄油溶剂。正常饮食饲养,观察动物活动、精神状况和饮食量 , 实验前后称量小鼠体重。
完成持续给药6周后,称体重,麻醉小鼠,摘眼球取血,室温静置2h后于4℃, 3000r离心10分钟提取血清,放入-80℃冰箱冻存。同时取肝左叶组织 1.5cm×1cm×0.2cm 于 10% 中性福尔马林中固定,石蜡包埋;其余肝组织液氮或者-80℃冷冻保存。
肝缺血(HI)小鼠模型
建模方法:
1. 小鼠术前12h禁食,自由饮水。
2. 麻醉小鼠,麻醉成功后将小鼠平躺在手术台上胶带固定四肢,将小鼠腹部术去毛,用碘酒和75%乙醇术区消毒。
3. 取腹正中切口 1cm,打开腹腔,小心分离出肝脏供血的门静脉和肝动脉。
4. 用无创血管夹夹闭门静脉和肝动脉,0.5min 后,肉眼可见阻断叶明显变白,说明阻断成功,用止血钳夹闭皮肤切口临时关闭腹腔,同时将小鼠放在37℃恒温加热垫上保温。
5. 完成持续缺血60min后,重新打开腹腔,迅速取出血管夹,恢复缺血肝血流,0.5min左右可见缺血区肝脏由白色逐渐恢复为鲜红色表明再灌注成功,逐层缝合腹腔肌肉和皮肤关闭腹腔,完成手术。待小鼠清醒后放回饲养室饲养,密切关注小鼠的状态及生存状况并做好记录。
参考文献
[1]Xiong J, Xu Y, Wang N, et al. Obstructive Sleep Apnea Syndrome Exacerbates NASH Progression via Selective Autophagy-Mediated Eepd1 Degradation. Adv Sci (Weinh). 2024;11(35):e2405955. (IF=14.3)
[2]Cui S, Xia T, Zhao J, et al. NDP52 mediates an antiviral response to hepatitis B virus infection through Rab9-dependent lysosomal degradation pathway. Nat Commun. 2023;14(1):8440. (IF=14.7)
[3]Rho H, Kim S, Kim SU, et al. CHIP ameliorates nonalcoholic fatty liver disease via promoting K63- and K27-linked STX17 ubiquitination to facilitate autophagosome-lysosome fusion. Nat Commun. 2024;15(1):8519. (IF=14.7)