免疫检查点抑制剂诱导的心肌炎的免疫反应特征
免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)作为一类革命性的癌症治疗药物,已在多种肿瘤类型的治疗中展现出了显著的疗效。然而,其潜在的副作用,特别是免疫相关不良事件(immune-related adverse events,irAEs)也给患者带来了新的风险。其中,ICIs诱导的心肌炎(irMyocarditis)作为一种严重的irAE,尽管发病率不高,但死亡率极高(20-50%)。而irMyocarditis发病机制至今尚未完全明确。
2024年11月6日,美国麻省总医院免疫与炎症疾病中心的Alexandra-Chloé Villani教授团队在《Nature》上发表了题为“Immune responses in checkpoint myocarditis across heart, blood and tumour”的文章。研究通过深入且系统性的免疫学分析,对irMyocarditis患者的心脏、血液和肿瘤样本进行分析,揭示了一系列新的循环标志物,明确了其关键的病理细胞类型,为irMyocarditis的核心发病机制提供了新的见解。

研究思路如下:
01 | irMyocarditis患者心脏和外周血免疫细胞群体分析
为了确定irMyocarditis中的关键细胞亚群,研究团队通过单细胞RNA测序(scRNA-seq)对来自irMyocarditis患者的84,576个心脏细胞和366,066个外周血单核细胞进行分析。在irMyocarditis患者的心脏组织中,T细胞和NK细胞显著富集。同时,这些免疫细胞内的DNA复制和细胞粘附相关基因显著上调,提示它们在心肌组织内正参与活跃的免疫反应。除了T/NK细胞外,心脏组织中还观察到单核吞噬细胞(MNP)、传统树突状细胞(cDC)和成纤维细胞的趋势性富集。这些细胞可能也在irMyocarditis的发病机制中发挥作用。在外周血中,MNP的比例显著增加。与此同时,pDC、cDC、B细胞和CD4 T细胞的比例均显著减少。这些变化表明irMyocarditis不仅影响心脏组织,还影响外周血中的免疫细胞分布。另外,基因集富集分析(GSEA)结果显示,无论是心脏还是外周血中的免疫细胞,都显著上调了与抗原呈递、干扰素信号、细胞粘附及病毒性心肌炎相关的通路。这一发现进一步支持了irMyocarditis是一种由多种免疫细胞相互作用引发的全身性炎症疾病的观点。研究还发现,外周血中MNP的比例与心肌损伤标志物-血清肌钙蛋白T(troponin T)水平呈正相关。这一结果提示MNP可能是反映irMyocarditis疾病严重性的潜在生物标志物。(图1)
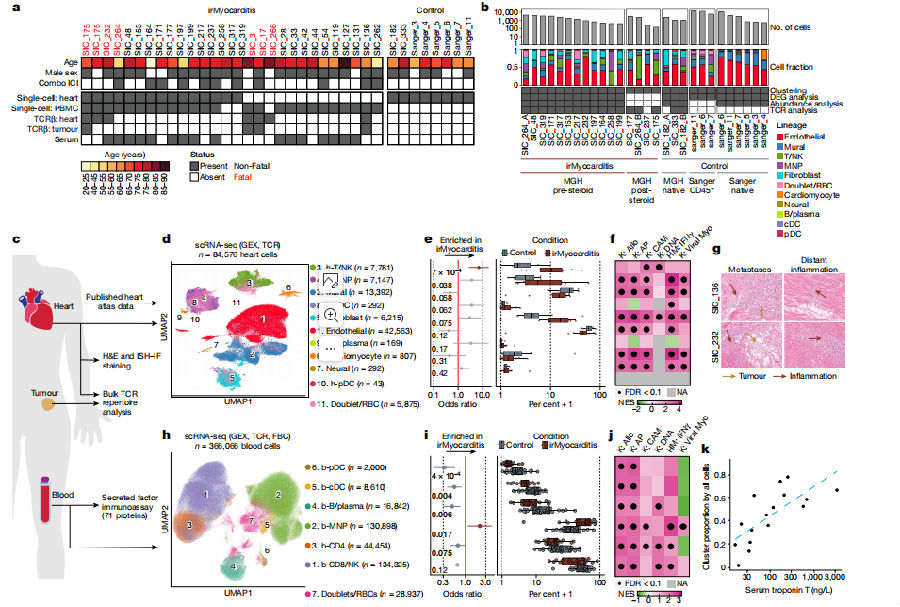
图1. irMyocarditis患者心脏和外周血中多种细胞的富集
(图片来源于《Nature》杂志)
02 | irMyocarditis患者心脏组织中T细胞的表型特征
为了确定irMyocarditis患者心脏组织中T细胞的表型特征,9,134个T/NK细胞被细分为六个亚群。在irMyocarditis患者的心脏组织中,CCL5hi NKG7hi h-CD8 T细胞和h-CD4 T细胞的丰度显著增加,Cycling h-CD8 T细胞和CD27hi LAG3hi h-CD8 T细胞也表现出丰度增加的趋势。另外研究发现,cycling h-CD8 T细胞的丰度与血清troponin T水平之间存在相关性,这可能为评估irMyocarditis的病情提供了一定的依据。基因集富集分析发现心脏组织中的T细胞显著上调了与抗原呈递、免疫受体信号、TCR信号传导、干扰素刺激/响应、细胞黏附以及DNA复制等相关的基因。这一发现进一步支持了T细胞在驱动irMyocarditis的致病性作用。为了识别与irMyocarditis发病机制相关的基因,研究团队利用血清troponin T进行了基因表达建模,发现与troponin T最相关的基因表达变化主要集中在T/NK谱系,包括与细胞周期(MKI67和TOP2A)、抗原呈递(HLA-DRA和HLA-DRB1)以及激活和衰竭(LAG3)相关的基因。(图2)
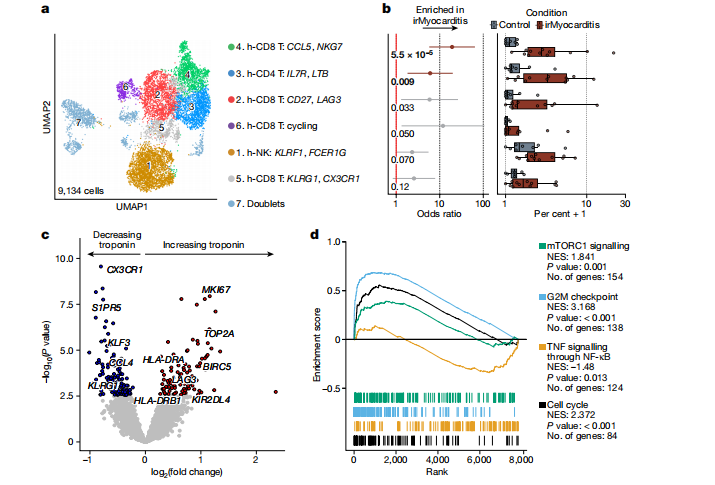
图2. irMyocarditis患者心脏组织中T细胞的表型特征
(图片来源于《Nature》杂志)
03 | irMyocarditis患者心脏组织中cDCs的富集及其疾病严重程度的关联
研究团队通过对9,824个MNP和树突状细胞(DCs)进行亚群分类,得到了五个不同的MNP亚群以及cDCs和pDCs。在这些亚群中,只有cDCs的丰度与血清troponin T水平显著相关。通过RNA原位杂交和免疫荧光等实验技术,研究团队验证了cDCs在irMyocarditis心脏中的显著富集。这种富集不仅体现在心脏整体水平上,更在炎症区域表现得尤为突出。进一步的分析显示,cDCs与h-CD8 T细胞在空间上的距离显著缩短。这一表现表明cDCs可能与h-CD8 T细胞存在紧密的相互作用,共同参与了irMyocarditis的病理生理过程。(图3)
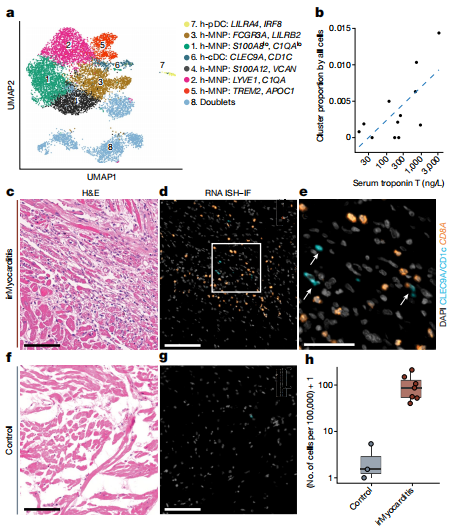
图3. irMyocarditis患者心脏组织中cDCs的富集及其疾病严重程度的关联
(图片来源于《Nature》杂志)
04 | irMyocarditis患者心脏组织中成纤维细胞的富集
为了研究成纤维细胞如何与炎症免疫细胞协作来推动疾病的进展。6,701个成纤维细胞谱系细胞细分为多个亚群,其中,CXCL9hiHLA-DRAhi fibroblasts在irMyocarditis患者心脏组织中显著富集,表达促炎趋化因子(CXCL9、 CXCL10、 CXCL11、CXCL16、CCL5和CCL19)。炎症成纤维细胞还上调表达多种与炎症相关的基因,包括抗原呈递相关的基因(如HLA-DRA和PSMB9)、细胞因子信号通路基因(如CXCL9和MDK)以及干扰素刺激基因(如GBP1和GBP4)。这些基因的表达变化不仅揭示了炎症成纤维细胞的活化状态,还暗示了它们在免疫应答和炎症调节中的潜在作用。特别是,它们可能通过分泌炎性细胞因子和趋化因子来招募和激活免疫细胞,从而加剧局部的炎症反应。原位杂交免疫荧光实验进一步验证了同时表达成纤维细胞标志物(如COL1A1和COL1A2)和炎性细胞因子(如CXCL9、CXCL10和CXCL11)的细胞的存在。这些细胞在空间位置上靠近h-CD8 T细胞和cDCs细胞,这表明它们之间可能存在紧密的相互作用。这种相互作用可能促进了免疫细胞的招募和激活,从而加剧了irMyocarditis的局部炎症反应。值得注意的是,这些炎症成纤维细胞仅在活动性irMyocarditis病例中检测到,而在愈合阶段的病例中未发现。这一发现进一步强调了炎症成纤维细胞在irMyocarditis疾病进展中的特异性作用。(图4)
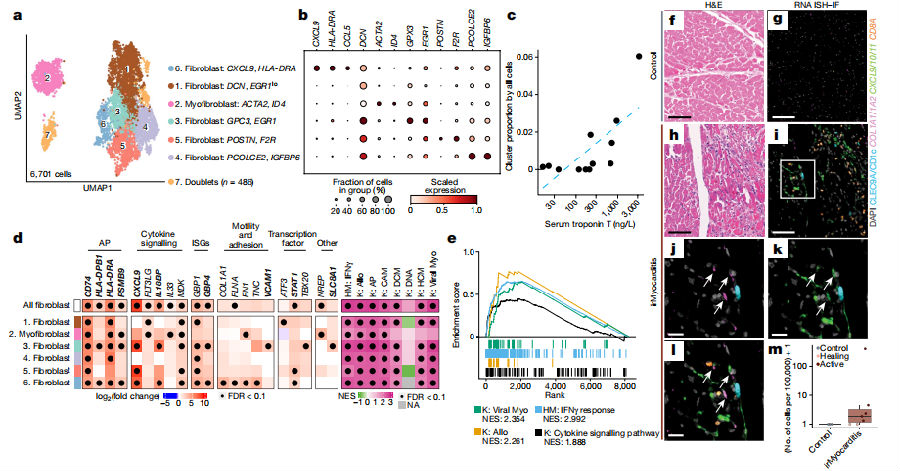
图4. irMyocarditis患者心脏组织中成纤维细胞的富集
(图片来源于《Nature》杂志)
05 | irMyocarditis的病理生理机制图
最后,研究团队总结了irMyocarditis的病理生理机制图(图5):Cycling h-CD8 T细胞和抗原呈递细胞(如cDCs)在心脏间质中被招募并滞留。这一过程中,成纤维细胞等间质细胞通过分泌炎性细胞因子和趋化因子,如CXCL9等,参与了免疫细胞的招募和滞留。这些免疫细胞在心脏中的积累导致了炎症的扩散和心肌细胞的损伤,从而引发了irMyocarditis的临床症状。
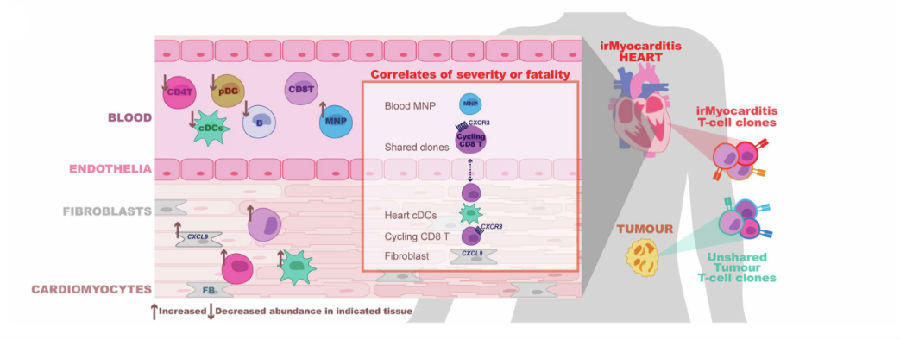
图5. irMyocarditis的病理生理机制图
(图片来源于《Nature》杂志)
这项研究不仅深化了我们对irMyocarditis病理生理机制的理解,还为免疫治疗的安全性和有效性提供了新的视角。未来,研究团队可以进一步探索这些生物学标志物和治疗靶点的临床应用价值,以及如何通过多学科合作来优化irMyocarditis的诊断和治疗策略。
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:
指标简称 | 核心货号 | 指标简称 | 核心货号 | 指标简称 | 核心货号 |
troponin T | MKI67 | TOP2A | |||
HLA-DRA | HLA-DRB1 | LAG3 | |||
CXCL9 | CXCL10 | CXCL11 | |||
CXCL16 | CCL5 | CCL19 | |||
PSMB9 | MDK | GBP1 | |||
GBP4 | COL1A1 | COL1A2 |