Nature:SPP1是破解前列腺癌免疫耐药性的新靶点
前列腺癌是男性最常见的恶性肿瘤,尽管初期治疗如使用雄激素剥夺疗法(ADT)有效,但许多患者最终还是会发展为晚期转移性去势抵抗性前列腺癌(mCRPC)并因此死亡。免疫检查点抑制剂(ICIs)在多种癌症治疗中显示出潜力,但在mCRPC患者中目前无效。因此,研究mCRPC中免疫治疗抵抗的机制,以及如何克服这种抵抗,是当前临床治疗的一个重要问题。2024年12月,《Nature》杂志上发表了一篇题为“Evolution of myeloid-mediated immunotherapy resistance in prostate cancer”的文章,在这项研究中,研究者探讨了髓系细胞介导的免疫治疗抵抗在前列腺癌中的演变,在mCRPC中发现了一种特定的肿瘤相关巨噬细胞(SPP1hi-TAMs)与ICIs抵抗之间的关系,提出了通过抑制腺苷A2A受体(A2ARs)来逆转这种抵抗的策略。

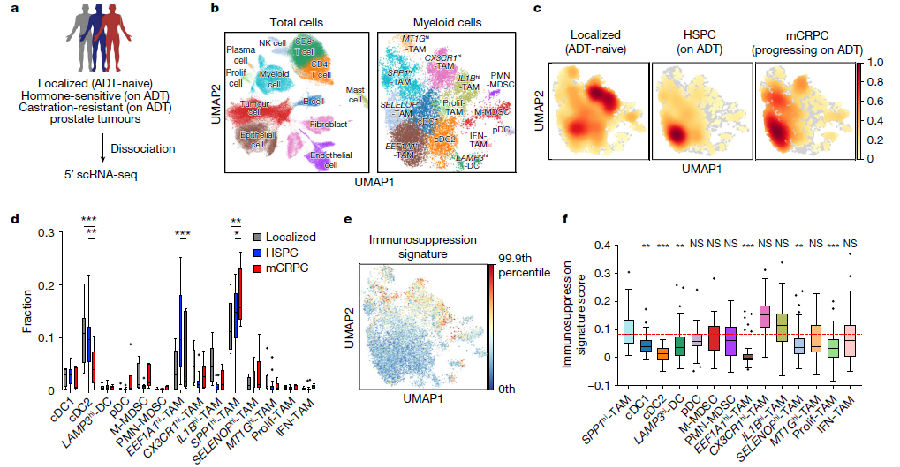
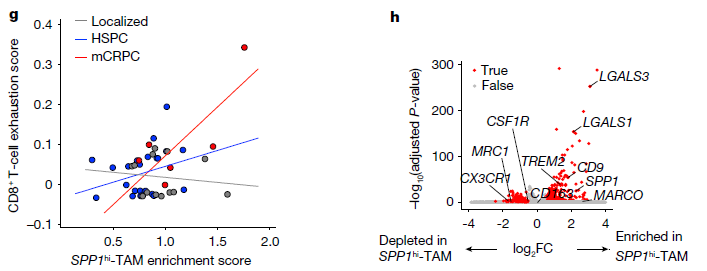
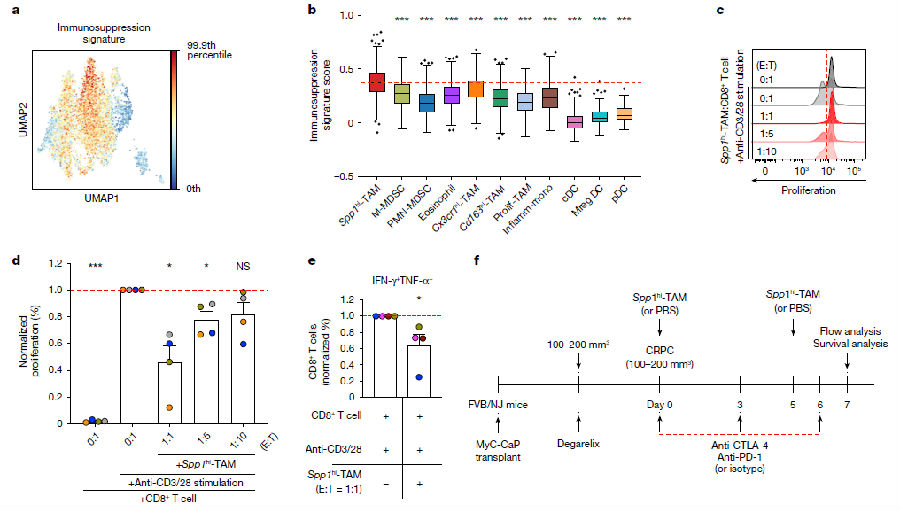
研究者们利用单细胞RNA测序(scRNA - seq)技术,对前列腺癌患者的肿瘤活检样本进行分析。样本包括未经ADT治疗的局部前列腺癌、接受ADT治疗的转移性激素敏感性前列腺癌(HSPC)以及在ADT治疗下进展为mCRPC的患者。通过差异表达基因分析,定义了肿瘤细胞和肿瘤微环境(TME)的主要成分。无监督聚类分析识别出8个巨噬细胞亚群,2个髓系来源抑制细胞(MDSC)亚群,3个树突状细胞(DC)亚群和浆细胞样DC(pDCs)。研究者发现在疾病进展过程中,以SPP1转录水平升高为特征的巨噬细胞数量显著增加,SPP1hi - TAMs表现出比其他髓系细胞亚群更高的免疫抑制分子程序。SPP1hi - TAM基因信号的升高与CD8+ T细胞衰竭程度显著相关,且随着疾病的进展,衰竭程度显著增加。这些结果表明,前列腺癌的进展导致TME内髓系细胞组成的动态变化,其中SPP1hi - TAMs成为免疫治疗耐药性的潜在驱动因素。
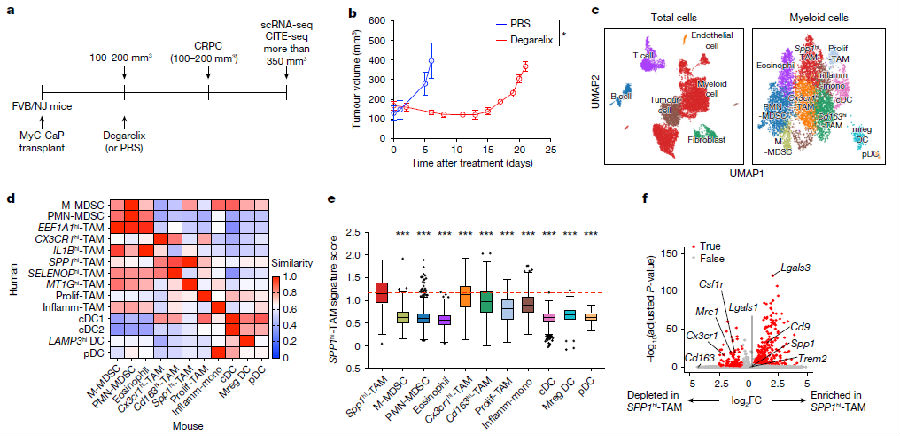
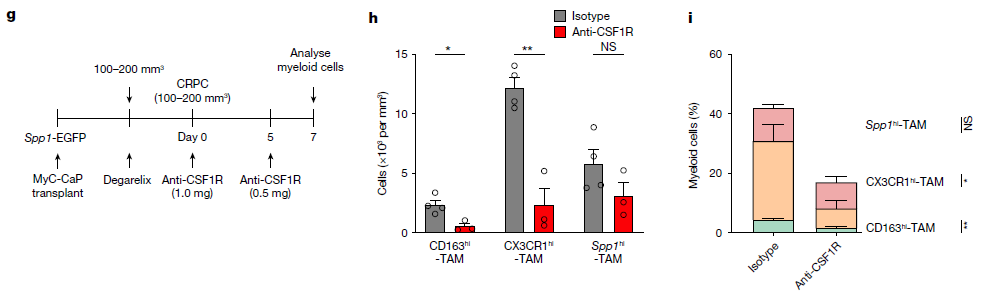
MyC-CaP是一种依赖雄激素的前列腺癌细胞系,源自患有前列腺癌的雄性小鼠。研究者对从皮下移植MyC-CaP的小鼠中分离的免疫(CD45+)和非免疫(CD45-)细胞,用醋酸地加瑞克(促性腺激素释放激素拮抗剂)或磷酸盐缓冲盐水(PBS)处理细胞,地加瑞克处理后肿瘤负荷显著消退,随后进展为CRPC。通过使用scRNA-seq,鉴定了TME中的6种主要细胞类型,以及11种不同的髓细胞亚群。通过对人和小鼠转录组的比较分析,发现了一个类似于人SPP1hi - TAMs的小鼠巨噬细胞亚群(Spp1hi - TAMs),其特征是Spp1、Cd9和Lgals3转录本的表达增加,而Csf1r、Mrc1、Cx3cr1和Cd163的表达减少。为了确定Spp1hi - TAMs是否对CSF1R阻断具有抗性,研究者给携带CRPC的小鼠注射了抗CSF1R抗体,高表达Csf1r的巨噬细胞被显著消融,但Spp1hi - TAMs基本未受影响,这表明Spp1hi - TAMs在CSF1R阻断处理耐药性中具有潜在作用。
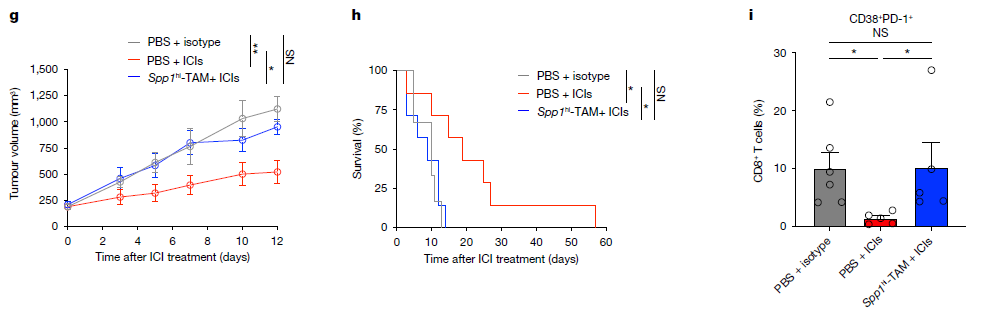
接着研究人员测试了Spp1hi - TAMs是否能在体内促进对ICIs的耐药性。前期实验结果表明,抗CTLA-4和抗PD-1抗体联合使用比单独使用更能显著降低CRPC的生长。为了验证Spp1hi - TAMs能介导免疫治疗耐药性,降低双联处理的有效性。在使用抗CTLA-4和抗PD-1联合处理的情况下,研究者将通过流式细胞术纯化的Spp1hi - TAMs转移到CRPC肿瘤中,最大限度地减少了Spp1hi - TAMs转运到TME的潜在问题。瘤内转移的Spp1hi - TAMs导致联合处理的效果显著降低,与对照组PBS和ICIs处理的肿瘤相比,Spp1hi - TAMs和ICIs处理显著增加了肿瘤中耗尽CD8+ T细胞的频率。这些结果表明Spp1hi - TAMs在驱动CRPC的免疫治疗耐药性方面起着关键作用。
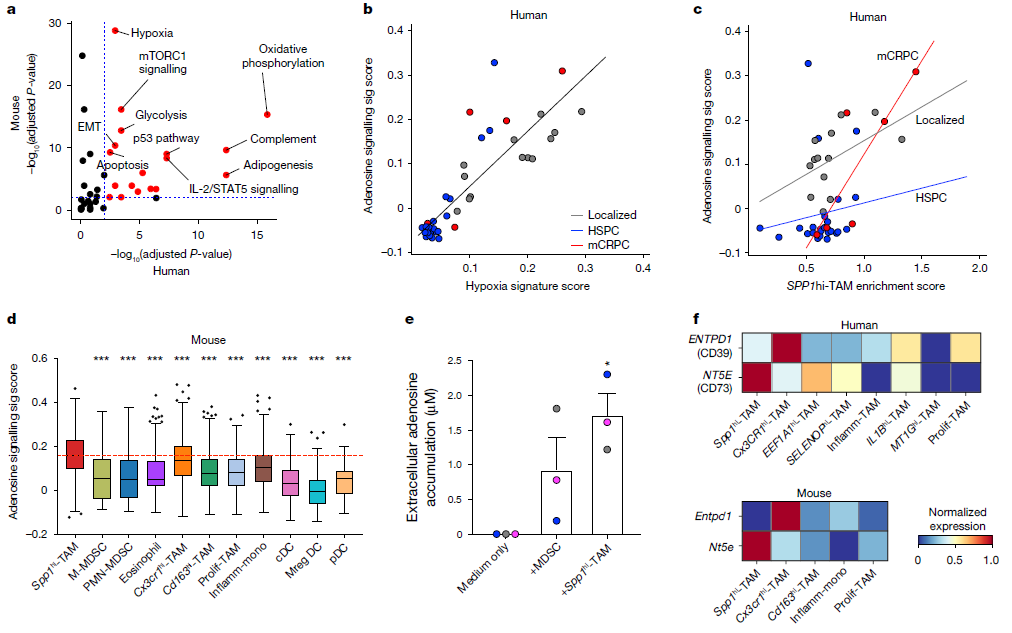
通过通路分析,研究者们确定了腺苷信号是SPP1hi-TAMs介导的免疫治疗抵抗的潜在机制。在体外实验中,抑制腺苷A2A受体(A2ARs)显著逆转了Spp1hi - TAMs介导的CD8+ T细胞免疫抑制。分析显示,与人类和小鼠的其他髓系亚群相比,SPP1hi-TAMs中NT5E的转录水平升高,且在mCRPC阶段更高。通过使用小分子抑制剂和阻断抗体进行实验,证明腺苷密切参与Spp1hi-TAMs的免疫抑制活动,但抑制腺苷途径不足以完全恢复T细胞增殖,提示还有其他机制促使Spp1hi-TAMs驱动免疫治疗耐药。(见图4)
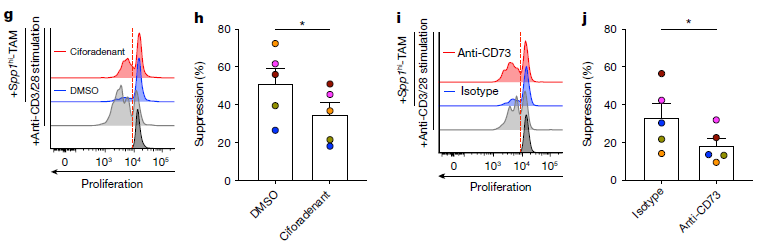
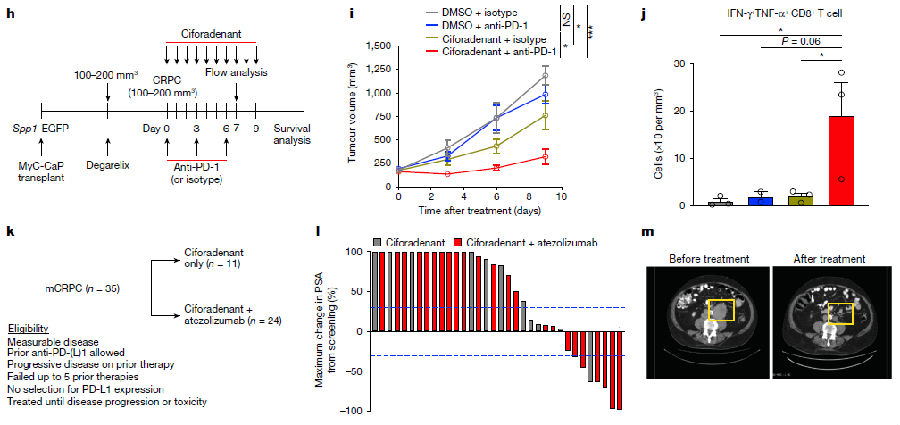
研究者用A2ARs抑制剂ciforadenant处理携带CRPC的小鼠,发现阻断A2ARs导致CRPC的生长显著减少。鉴于用ciforadenant处理后,耗竭的CD8+ T细胞和Spp1hi -TAMs的丰富度显著降低,研究者推测A2AR阻断可能会增强ICIs的疗效。于是,研究人员给患有CRPC的小鼠联合使用ciforadenant和抗PD-1,A2AR和PD-1的双重阻断导致肿瘤生长的减少幅度显著大于单一疗法,表明A2AR抑制有助于增强免疫检查点抑制剂在CRPC中的疗效。对淋巴细胞亚群评估发现,ciforadenant可增加多功能 CD8+ T细胞的频率,PD-1阻断可增强 T 细胞和NK细胞向肿瘤的浸润,联合使用可增加多功能CD8+ T细胞的密度,提示联合处理增强抗肿瘤活性的潜在机制。
在临床试验中,评估A2AR阻断对人类免疫治疗耐药性的影响,对mCRPC患者单独使用 ciforadenant(n = 11)或与阿替利珠单抗(atezolizumab)联合使用(n = 24)。该治疗方案耐受性良好,主要副作用发生率很低。24名联合用药患者中有6名(25%)前列腺特异性抗原水平较基线下降30%及以上,且部分有可测量病灶的患者观察到肿瘤缩小。此外,抑制A2ARs还导致CRPC中SPP1hi-TAMs的丰度显著下降,表明这一途径在诱导和下游免疫抑制中都具有作用。这些发现表明,针对腺苷信号的治疗干预可能是使mCRPC对ICIs治疗敏感的潜在策略。(见图5)

总的来说,这些研究确定了SPP1hi-TAMs作为mCRPC中ICIs抵抗的关键介质,并强调了它们作为治疗靶点和预测治疗效果潜在生物标志物的重要性。这些发现为前列腺癌的免疫治疗提供了新的视角,并为克服免疫治疗抵抗提供了潜在的策略。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关研究,部分指标节选如下,供参考:
指标名 | 核心货号 | 指标名 | 核心货号 |
CD3 | A563 | CD4 | L630 |
CD19 | B873 | CD8 | B099 |
CD38 | A752 | ENTPD1 | B118 |
CD73 | B250 | PD1 | A751 |
CD45 | B030 | IFNg | A049 |
CD11b | B685 | TNFa | A133 |
SPP1 | A899 | PDL1 | A788 |