自噬与肠道稳态:探索炎症性肠病的治疗新方向
肠道可以被视为一个器官系统,在吸收营养的同时,在防御和耐受高微生物负荷之间保持微妙的平衡。这种平衡在炎症性肠病(IBD)中被打破。有证据表明,IBD的发病机制涉及肠道内稳态的改变,导致宿主对粘膜屏障处共生菌群的不适当免疫反应。该屏障具有多层防御,包括多种上皮细胞类型的特殊功能,维持细胞旁通透性的紧密连接,以及肠干细胞生态位介导的快速细胞更新。自噬已经发展成为一种细胞防御、微生物耐受性和代谢控制系统,直接影响细胞和器官水平的稳态。自噬系统的紊乱会导致支持维持肠道稳态的先天免疫和适应性免疫的多个方面崩溃。自噬和免疫细胞之间的串扰支持肠道稳态,这种沟通的中断与肠道屏障功能缺陷有关。因此,进一步了解自噬和自噬依赖性通路在肠道稳态中的作用,可能会确定合适治疗靶点提供帮助。
1. 自噬通过减轻ER应激来控制肠杯状细胞的粘液分泌
结肠杯状细胞是一种特殊的上皮细胞,它分泌粘液,将宿主及其微生物群物理分离,从而防止细菌入侵和炎症。杯状细胞是如何控制它们分泌的粘液量的还不清楚。以色列巴伊兰大学Azrieli医学院Shai Bel团队发现,通过Beclin 1激活小鼠自噬,可以减少内质网(ER)应激,产生更厚、更不易穿透的黏液层[1]。因此,抑制Beclin 1诱导的自噬会损害粘液分泌,而药理学上缓解ER应激会导致粘液过量产生。这种ER应激介导的粘液分泌调节依赖于微生物群和克罗恩病(CD)风险基因Nod2(图1)。粘液的过量产生会改变肠道微生物组,特别是扩大利用粘液的细菌,如Akkermansia muciniphila,并防止化学和微生物驱动的肠道炎症。因此,ER应激是一种限制粘液分泌的细胞内在开关,而自噬通过缓解ER应激来维持肠道稳态。
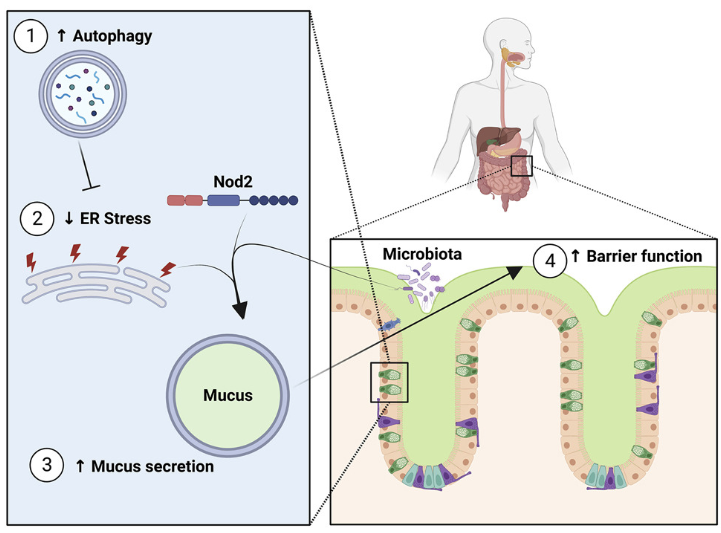
图1 自噬通过减轻ER应激控制肠杯状细胞粘液分泌
2. 巨噬细胞LRRK2过度活跃损害自噬并诱导Paneth细胞功能障碍
LRRK2多态性(G2019S/N2081D)增加了CD的易感性,导致LRRK2激酶过度活跃并抑制自噬。这种联系表明,LRRK2激酶抑制可能对CD患者有益。Paneth细胞稳态受到自噬的严格调节,其功能障碍是CD肠道炎症的前兆。美国华盛顿大学医学院病理与免疫学系Ta-Chiang Liu团队发现CD患者和携带过度活跃LRRK2多态性的小鼠出现Paneth细胞功能障碍[2]。此外,LRRK2激酶可以在基因和环境之间的相互作用中被激活(图2)。LRRK2介导的吞噬细胞释放促炎细胞因子会损害Paneth细胞功能,而LRRK2激酶的抑制通过激活自噬来挽救Paneth细胞的功能。这些数据表明,LRRK2激酶抑制剂通过恢复自噬来维持Paneth细胞的稳态,并可能代表CD的一种治疗策略。
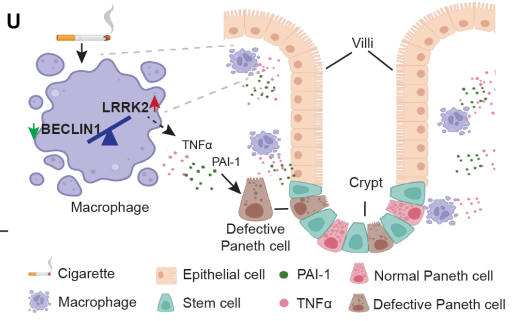
图2 基因-环境相互作用触发Paneth细胞缺陷
3. CCDC50介导的自噬对NLRP3炎性小体激活的调控
NLRP3炎性小体的组装可以由多种刺激引发,包括外源性感染和内源性损伤。因此,NLRP3炎性体的严格调控对于宿主抵抗微生物入侵和维持体内平衡至关重要。中山大学医学院感染与免疫研究中心热带病控制教育部重点实验室Deyin Guo团队确定了NLRP3介导的炎症的负调节因子,即CCDC50[3]。CCDC50可以被NLRP3激动剂诱导,然后作为自噬受体发挥作用,识别K63多泛素化的NLRP3,并将其传递给MAP1LC3/LC3结合的吞噬细胞进行降解(图3)。CCDC50抑制NLRP3的聚合和PYCARD/ASC的募集,从而抑制炎性小体的组装。ccdc50敲除小鼠更容易患硫酸葡聚糖诱导的结肠炎,并表现出更严重的肠道炎症,NLRP3炎性小体活性升高,表明CCDC50在IBD的病理和进展中起着保护作用。这些发现揭示了自噬相关蛋白在调节NLRP3介导的炎症中的作用,从而证明了自噬和炎症之间复杂的相互作用。
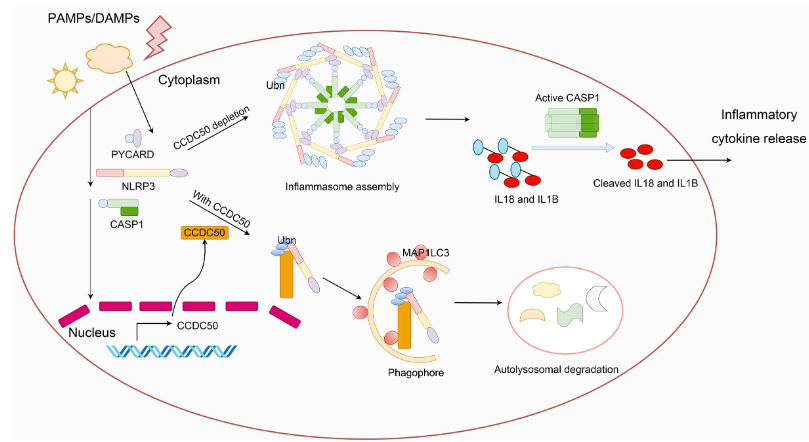
图3 CCDC50调节NLRP3炎性小体激活的工作模型示意图
云克隆不仅可提供肠易激综合征、克罗恩病、溃疡性结肠炎、胃溃疡、胃炎、十二指肠溃疡等常见消化疾病动物模型,还具有多个物种肠成纤维细胞、结肠上皮细胞、结肠平滑肌细胞等原代细胞和各类肠胃疾病检测指标及上述Beclin 1、LRRK2、NLRP3、MAP1LC3等相关产品,可助力广大科研工作者进行自噬和肠道疾病相关研究。
相关动物模型
肠易激综合征(IBS)大鼠模型
建模方法:

结肠炎小鼠模型
建模方法:
参考文献
[1]Naama M, Telpaz S, Awad A, et al. Autophagy controls mucus secretion from intestinal goblet cells by alleviating ER stress. Cell Host Microbe. 2023;31(3):433-446.e4. (IF=20.6)
[2]Sun S, Hodel M, Wang X, et al. Macrophage LRRK2 hyperactivity impairs autophagy and induces Paneth cell dysfunction. Sci Immunol. 2024;9(101):eadi7907. (IF=17.6)
[3]Hou P, Tian T, Jia P, et al. The regulation of NLRP3 inflammasome activation by CCDC50-mediated autophagy. Autophagy. 2023;19(1):365-366. (IF=14.6)