铁死亡:细胞死亡的新视角,疾病治疗的新希望
铁死亡是近年来发现的一种新型细胞死亡,在细胞死亡过程中通常伴有大量的铁蓄积和脂质过氧化,其发生是铁依赖性的。铁死亡诱导因子可通过不同的途径直接或间接影响谷胱甘肽过氧化物酶,导致细胞抗氧化能力下降和脂质活性氧(ROS)积累,最终导致氧化性细胞死亡。近年来的研究表明,铁死亡与肿瘤、神经系统疾病、缺血再灌注损伤、肾损伤、血液病等许多疾病的病理生理过程密切相关。如何通过调控细胞铁死亡干预相关疾病的发生发展已成为研究和治疗的热点和重点,但铁死亡的功能变化和具体分子机制仍有待进一步探索。近期,多篇文献报道了铁死亡相关研究,可能为开发新的自噬相关药物和疗法提供帮助。
1. 7-脱氢胆固醇决定铁死亡的敏感性
铁死亡是一种受铁依赖性磷脂过氧化作用驱动的细胞死亡形式,与多种疾病有关。利用全基因组CRISPR-Cas9筛选,上海同济大学医学院Ping Wang团队发现参与远端胆固醇生物合成的酶通过决定7-脱氢胆固醇(7-DHC)的水平在调节铁死亡中具有关键作用[1]。研究人员发现,MSMO1、CYP51A1、EBP和SC5D等通路组分是铁死亡的潜在抑制因子,而DHCR7则是一个促铁死亡基因。在机制上,7-DHC通过使用共轭二烯发挥其抗磷脂自氧化功能,并保护血浆和线粒体膜免受磷脂自氧化,从而指示铁死亡监测(图1)。重要的是,通过药物靶向EBP阻断内源性7-DHC的生物合成可诱导铁死亡并抑制肿瘤生长,而通过抑制DHCR7增加7-DHC水平可有效促进癌症转移并减轻肾脏IRI的进展,支持该轴在体内的关键功能。
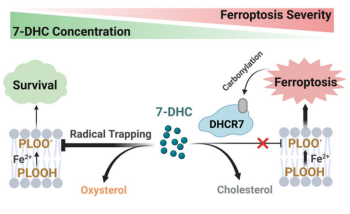
图1 铁死亡期间7-DHC的水平调节
2. OPA1通过增加线粒体ROS和抑制综合应激反应促进铁死亡
亚细胞细胞器在铁死亡的调节中起着关键作用,但线粒体的作用机制尚不清楚。Optic atrophy 1(OPA1)是一种线粒体动力蛋白样GTP酶,控制线粒体形态发生、融合和能量学。美国布朗克斯阿尔伯特爱因斯坦医学院医学系Richard N. Kitsis团队报告说,缺乏OPA1的人类和小鼠细胞对铁死亡具有明显的抵抗力[2]。OPA1突变体的重组表明,铁死亡致敏需要GTP酶活性,但与OPA1介导的线粒体融合无关。从机制上讲,OPA1通过维持线粒体稳态和功能来增加铁死亡的易感性,这有助于线粒体脂质ROS的产生和ATF4介导的综合应激反应的抑制(图2)。这些结果共同确定了OPA1控制的线粒体铁死亡调节轴,并为治疗性操纵疾病中这种形式的细胞死亡提供了机制见解。

图2 OPA1通过增加线粒体ROS和抑制综合应激反应促进铁死亡
3. 小分子MIF调节通过破坏DNA修复机制增强铁死亡
尽管过度的脂质过氧化是铁死亡的决定性标志,但DNA损伤也可能发挥重要作用。荷兰格罗宁根大学格罗宁根药学研究所化学与药物生物学系Frank J. Dekker团队确定了巨噬细胞迁移抑制因子(MIF)在同源重组(HR)DNA修复中的潜在机制作用[3]。MIF或其他HR蛋白,如癌症1型易感性蛋白(BRCA1)的抑制或遗传缺失被证明显著增强了细胞对铁死亡的敏感性。对HR的干扰导致肿瘤抑制蛋白p53易位到线粒体,进而刺激活性氧的产生(图3)。这些发现表明,MIF导向的小分子通过HR中假定的MIF-BRCA1-RAD51轴增强铁死亡,这会导致对铁死亡的抵抗。
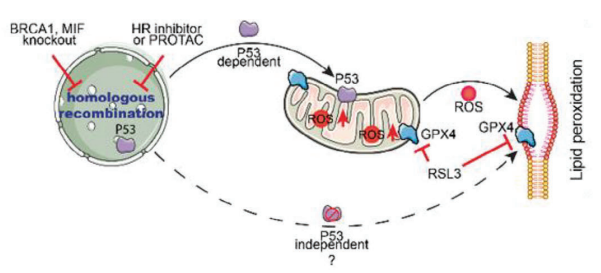
图3 P53通过转运到线粒体促进HR缺陷细胞中的脂质过氧化,从而诱导ROS的产生
4. PRDX6通过指导细胞硒的利用来决定铁死亡的敏感性
硒依赖性谷胱甘肽过氧化物酶4(GPX4)是铁死亡的守护者,通过减少磷脂氢过氧化物(PLOOH)来防止无限制的脂质过氧化。然而,其他磷脂过氧化物酶在铁死亡保护中的作用尚不清楚。德国Helmholtz Munich代谢和细胞死亡研究所Marcus Conrad团队发现,缺乏GPX4的细胞仍然表现出显著的PLOOH还原能力,这表明存在替代的PLOOH过氧化物酶[4]。通过仔细检查潜在的候选物,他们发现,尽管过氧化氧还蛋白6(PRDX6)的过度表达未能预防铁死亡,但其基因缺失使癌症细胞对铁死亡敏感。从机制上讲,PRDX6除了其已知的过氧化物酶活性外,还充当硒受体蛋白,促进细胞内硒的利用,并有效地将硒掺入硒蛋白,包括GPX4(图4)。GPX4在prdx6缺陷小鼠脑中的表达减少,prdx6缺陷小鼠肿瘤异种移植物对铁死亡的敏感性增加。这些研究强调了PRDX6在指导细胞硒利用和决定铁死亡敏感性方面的关键作用。
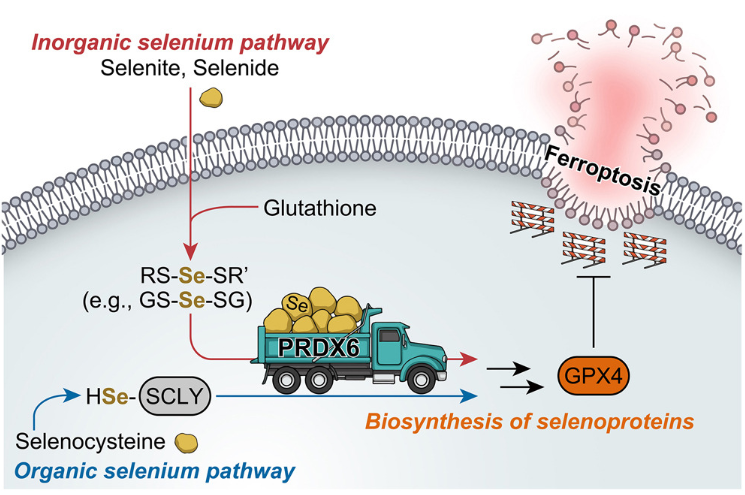
图4 PRDX6通过指导细胞硒的利用来决定铁死亡的敏感性
云克隆不仅可提供多种细胞死亡(凋亡、自噬、铁死亡、焦亡)信号通路相关产品,包括TNFα、CASP3、CTSK、NFkB、CASP9、Bcl2、BECN1、CTSD、CTSL、ERK1、ERK2等,还具有上述DHCR7、OPA1、ATF4、BRCA1、MIF、RAD51、GPX4、PRDX6等相关蛋白检测产品,可助力广大科研工作者进行细胞死亡相关研究。
参考文献
[1]Li Y, Ran Q, Duan Q, et al. 7-Dehydrocholesterol dictates ferroptosis sensitivity. Nature. 2024;626(7998):411-418. (IF=50.5)
[2]Liang FG, Zandkarimi F, Lee J, et al. OPA1 promotes ferroptosis by augmenting mitochondrial ROS and suppressing an integrated stress response. Mol Cell. 2024;84(16):3098-3114.e6. (IF=14.5)
[3]Chen D, Zhao C, Zhang J, et al. Small Molecule MIF Modulation Enhances Ferroptosis by Impairing DNA Repair Mechanisms. Adv Sci (Weinh). 2024;11(32):e2403963. (IF=14.3)
[4]Ito J, Nakamura T, Toyama T, et al. PRDX6 dictates ferroptosis sensitivity by directing cellular selenium utilization. Mol Cell. 2024;84(23):4629-4644.e9. (IF=14.5)