中和GDF-15可打破实体瘤对免疫检查点抑制剂的耐药性
利用抗体阻断免疫检查点分子的癌症免疫疗法在多种癌症中具有临床活性,但反应率有限,而且经常肿瘤进程还是会发展。为此,科学家一直在努力寻找进一步增强抗PD-1/PD-L1疗法作用的方法,其中一种思路是找到在肿瘤中促进药物耐受的分子,并对其进行干预。肿瘤微环境中的可溶性的且能与细胞结合的因子对肿瘤免疫有负面影响,能够抑制免疫反应。有研究证明GDF-15(growth differentiation factor 15),TGF-β超家族的一员,能在许多癌症类型中大量产生,在肿瘤微环境中高表达,可抑制抗肿瘤免疫反应。在临床前癌症模型中,GDF-15阻断可协同增强抗PD-1介导的抑制检查点的效果。
2024年12月11日,有研究团队在《Nature》期刊上发表了题为“Neutralizing GDF-15 can overcome anti-PD-1 and anti-PD-L1 resistance in solid tumours”的文章,在一项人体1-2a期研究中,对抗PD-1/抗PD-L1治疗无效的晚期癌症患者接受了visugromab(CTL-002)中和抗体(抗GDF-15抗体)与抗PD-1抗体nivolumab的联合治疗。研究发现,在一些非鳞状非小细胞肺癌(NSCLC)和尿路上皮癌(UC)患者中,联合治疗实现了持久和深度的反应,在筛选后确定GDF-15具有免疫抑制功能。治疗后,细胞毒性T细胞的肿瘤浸润、增殖、interferon-γ(干扰素γ)相关信号和granzymeB(GZMB,颗粒酶B)表达水平升高。表明中和GDF-15有望克服癌症对免疫检查点抑制的耐药性。

研究者首先开展了1期临床实验,招募了25名肿瘤患者。采用“3+3”剂量递增方案,患者首先接受了一定剂量的visugromab,一定时间后加入PD-1抑制剂nivolumab。1期临床结果显示,visugromab与nivolumab联用不会引起严重的副作用,无剂量限制性毒性(DLT),并且联合疗法使用后,部分患者表现出显著的临床获益,包括部分缓解(PR)和完全缓解(CR),在部分患者中观察到T细胞的增殖活性更强,肿瘤浸润T细胞数量增加,包括CD8+T细胞和CD3+GZMB+ 细胞毒性T细胞。(见图1)
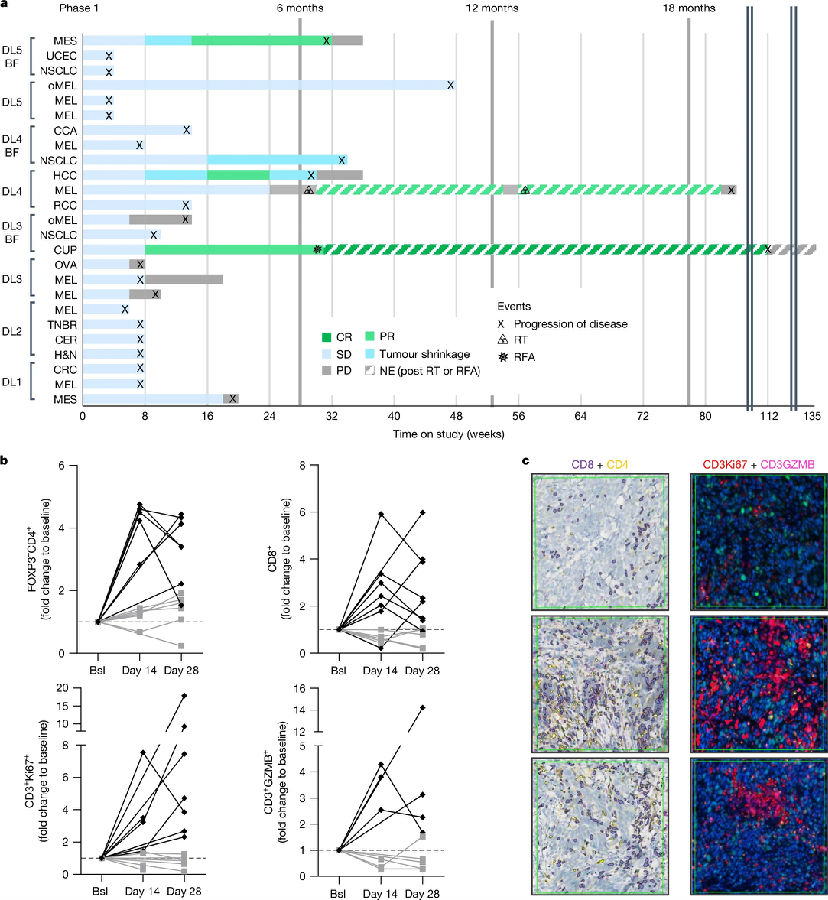
图1. 1期临床实验,visugromab联合nivolumab使用
(图片来源于《Nature》杂志)
为了确定受GDF-15影响的肿瘤类型,研究者进行了综合高通量泛癌症免疫转录组学分析。从癌症基因组图谱(TCGA)中检索了33种癌症类型的临床数据,包括大约10000个患者来源的肿瘤,详细分析了GDF15在肿瘤和正常组织中的表达模式。在转录组学分析的基础上,研究者认为NSCLC和UC是对GDF-15中和敏感的肿瘤类型,故而选择了这两种肿瘤类型进行进一步的2a期研究。(见图2)
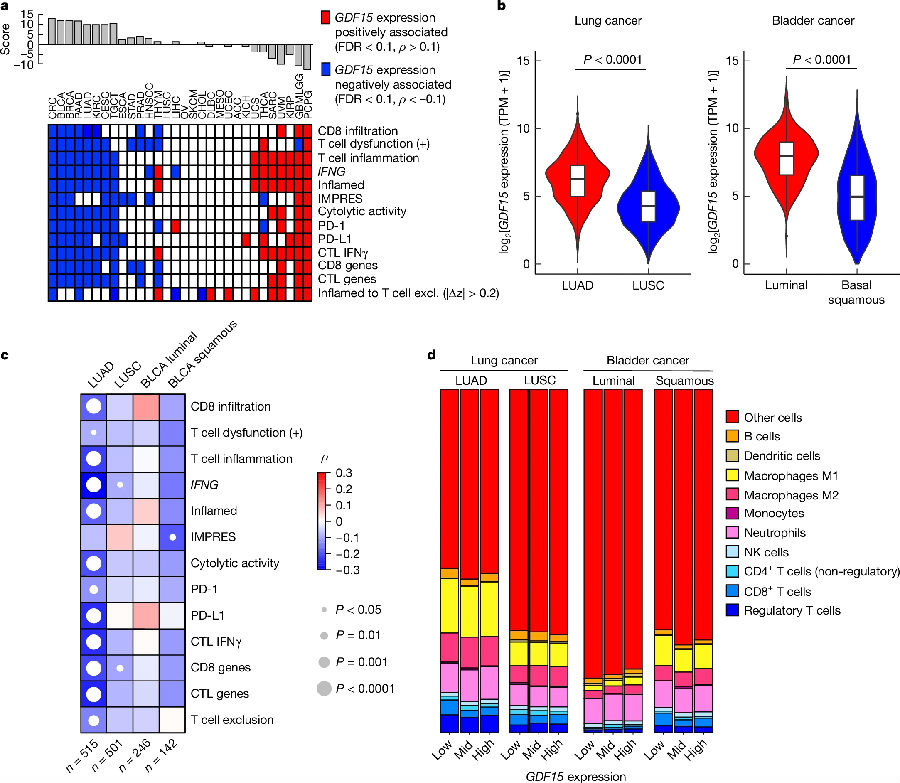
图2. TCGA数据中GDF15与免疫特征抑制的相关性
(图片来源于《Nature》杂志)
基于1期临床得到的安全性结果,在2a期临床中招募了27名NSCLC和27名UC患者参与实验,这些患者为抗PD-1/PD-L1治疗耐药或复发的晚期癌症患者。在2a期临床中,患者接受了visugromab和nivolumab联合治疗。在NSCLC和UC患者中,联合治疗的总体肿瘤缓解率(ORR)分别为19.0%和18.5%,显著高于单一抗PD-1治疗在此类患者中的ORR(0–5%)。(见图3)
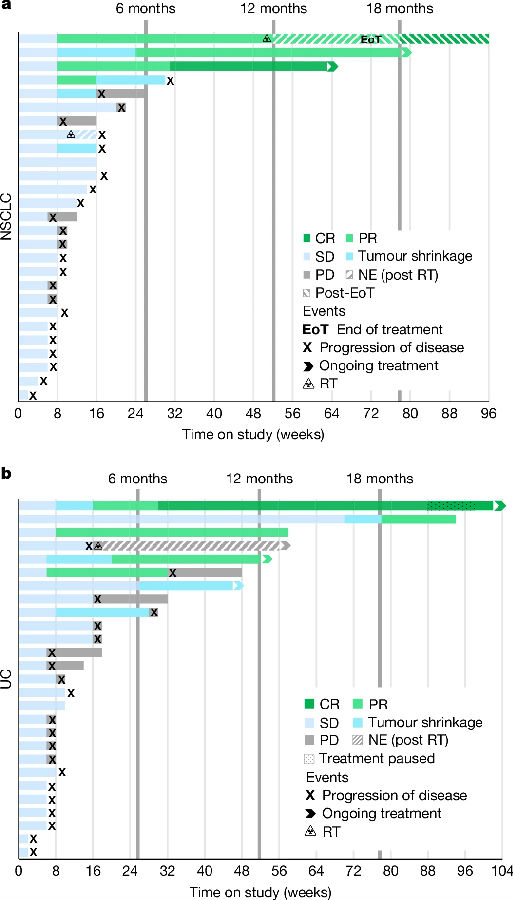
图3. Visugromab和nivolumab联合使用可诱导部分抗PD-1/PD-L1复发或耐药性晚期NSCLC和UC的缓解
(图片来源于《Nature》杂志)
由于在1期visugromab治疗中观察到T细胞密度增加,因此研究者进行了进一步深入的RNA分析,发现visugromab治疗诱导了炎症基因如CXCL9、CXCL10、CCL8、CCR5和IRF7的表达,且与干扰素和细胞因子信号传导相关的通路也被诱导了。进一步研究结果表明具有干扰素-γ诱导作用的CXCL9/10的血清表达水平在治疗后显著升高。(见图4)
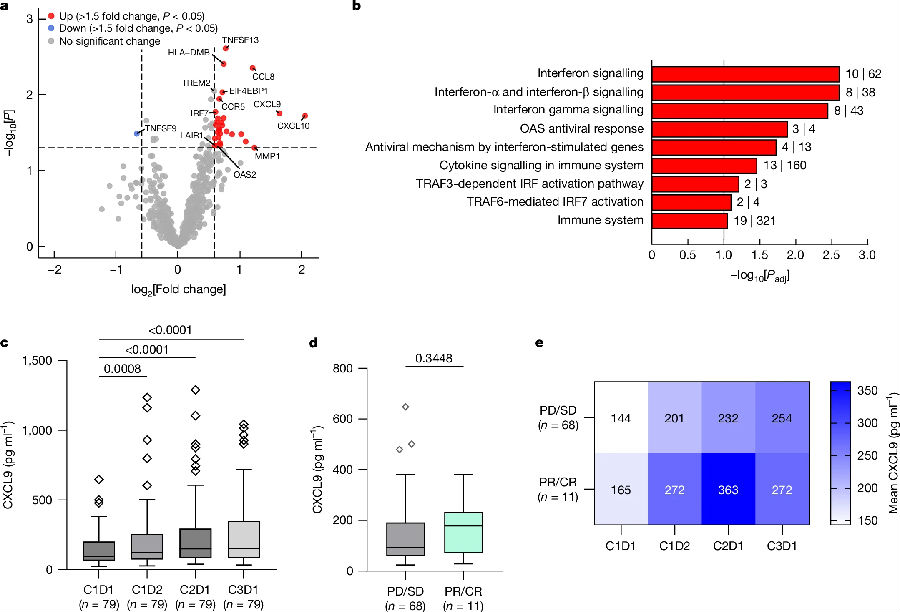
图4. 干扰素γ信号在部分抗PD-1和PD-L1复发或耐药晚期癌症中的诱导作用
(图片来源于《Nature》杂志)
GDF-15通过抑制T细胞迁移和激活,在肿瘤微环境中发挥免疫抑制作用。联合疗法提升了肿瘤内部浸润T细胞的数量,如CD8+T细胞;PD-L1阳性的肿瘤细胞占比开始发生下降;GZMB和干扰素-γ等关键免疫效应因子的表达显著增加;且肿瘤体积显著减小甚至肿瘤完全缓解。相较于常规抗PD-1疗法,联合疗法可以使患者的复发时间延后,增强抗肿瘤免疫反应,使患者的肿瘤体积得到更有效地控制。靶向GDF-15的抗体与免疫检查点抑制剂联用,可能可以成为进一步增强现有免疫疗法效果的潜在策略。
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:
更多信息,欢迎访问:http://www.cloud-clone.cn/