铁死亡:解码肝病新机制与靶向治疗的突破之路
铁死亡以铁过度积累和脂质过氧化为特征,是一种新型的铁依赖性细胞死亡,在形态学、遗传学和生化学上与其他已知的细胞死亡不同。肝脏作为人体主要的铁储存器官,在铁代谢失衡时易受到损伤,进而导致一系列严重的肝病。铁死亡的病理生理学相关性首先在肝脏的缺血/再灌注损伤(IRI)中得到证实。此后,大量研究表明,脂质过氧化和铁死亡在众多肝脏疾病模型中起着核心作用,包括血色病、酒精相关性肝病(ALD)、病毒性肝炎、非酒精性脂肪性肝炎(NASH)和肝细胞癌(HCC)。调控铁死亡为治疗肝脏疾病提供了新的策略。铁死亡抑制剂如去铁胺(DFO)、去铁酮和环吡酮螯合铁,通过限制芬顿反应防止脂质过氧化的传播。此外,通过调节GPX4、线粒体DHODH和NRF2等信号通路,也可有效抑制铁死亡。深入研究铁死亡的调控机制,不仅有助于进一步理解肝脏疾病的病理过程,也为开发新的治疗手段提供了重要方向。
1. GPR56能够感知类固醇激素17α-羟基孕烯醇酮,从而保护肝脏免受铁死亡引起的损伤
G蛋白偶联受体(GPCR)介导大多数细胞对激素、神经递质和环境刺激物的反应。然而,GPCR是否通过铁死亡参与组织稳态尚不清楚。山东大学齐鲁医学院基础医学院Bo Chu团队发现GPR56/ADGRG1使细胞对铁死亡具有抗性,GPR56的缺乏会加剧阿霉素(DOX)或缺血再灌注(IR)诱导的铁死亡介导的肝损伤[1]。从机制上讲,GPR56通过促进CD36的内吞溶酶体降解来降低含有游离多不饱和脂肪酸(PUFA)的磷脂的丰度。他们发现17α-羟基孕烯醇酮(17-OH PREG)作为GPR56的激动剂,可以拮抗铁死亡,有效减轻损伤前后的肝损伤(图1)。这些发现揭示了17-OH PREG-GPR56轴介导的信号转导作为一种新的抗铁死亡途径来维持肝脏稳态,为肝损伤的潜在治疗提供了新的见解。
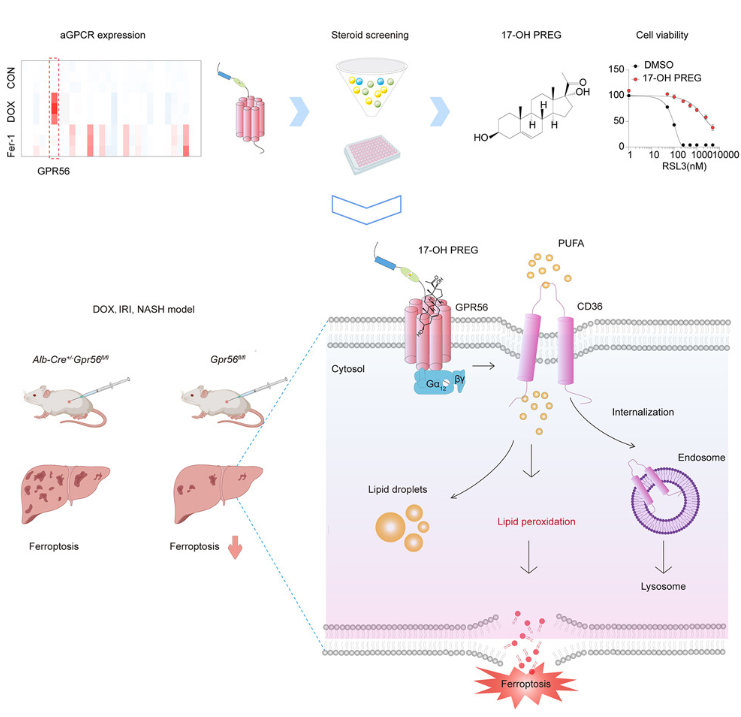
图1 17-OH PREG-GPR56保护肝脏免受铁死亡引起的损伤
2. NCF1对活性氧的调节控制库普弗细胞对MASH的铁死亡易感性
库普弗细胞(KC)的自我更新受损会导致代谢功能障碍相关脂肪性肝炎(MASH)的炎症。西安交通大学第二附属医院传染病科Liesu Meng团队确定中性粒细胞胞浆因子1(NCF1)是KC中铁稳态的关键调节因子[2]。NCF1在患有代谢功能障碍相关脂肪变性肝病的人和MASH小鼠的肝巨噬细胞和树突状细胞中上调。巨噬细胞NCF1会引发KC铁超载、铁死亡和单核细胞衍生的巨噬细胞浸润,从而加剧MASH的进展(图2)。从机制上讲,巨噬细胞NCF1诱导的氧化磷脂升高促进了Toll样受体(TLR4)依赖性肝细胞铁调素的产生,导致KC铁沉积增加和随后的KC铁沉积。此外,人类低功能多态性变异NCF190H减轻了小鼠的KC铁死亡和MASH。这项研究提示NCF1可作为改善KC命运和限制MASH进展的治疗靶点。
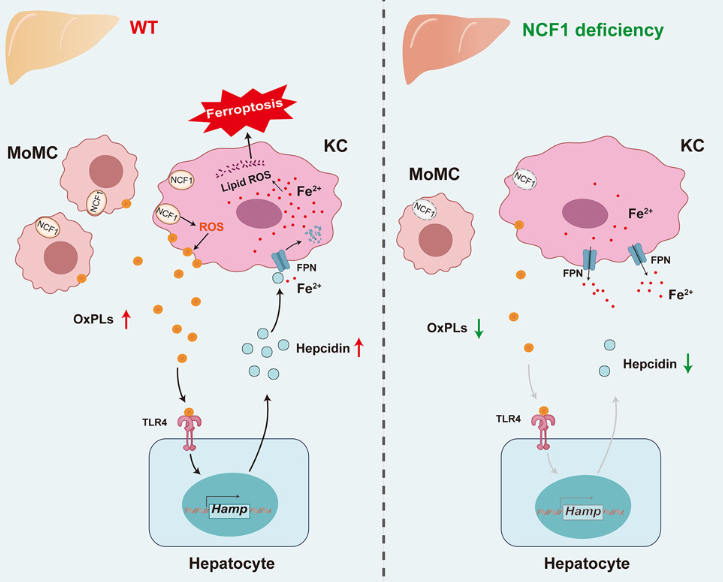
图2 巨噬细胞NCF1导致KC自我更新受损和MASH的发展
3. MafG/MYH9-LCN2轴通过抑制肝星状细胞铁死亡促进肝纤维化
肝星状细胞(HSC)分泌细胞外基质以促进胶原沉积,从而导致肝纤维化。调节HSC中的铁死亡可能对肝纤维化具有治疗潜力。中南大学湘雅医院Yongheng Chen团队发现Maf-bZIP转录因子G(MafG)在人类和小鼠肝纤维化中上调[3]。MafG敲除增加了HSC的铁死亡,而MafG过表达赋予了HSC对铁死亡的抵抗力。从机制上讲,MafG与非肌肉肌球蛋白重链IIa(MYH9)发生物理相互作用,以转录激活脂质运载蛋白2(LCN2)的表达,LCN2是一种已知的铁细胞凋亡抑制剂。在MafG敲除的HSC中LCN2的再表达恢复了对铁死亡的抵抗力。在胆管结扎(BDL)诱导的小鼠模型中,他们发现用Erastin治疗可以通过诱导HSC铁死亡来缓解小鼠肝纤维化。这些结果表明,MafG抑制HSC铁死亡,通过转录激活LCN2表达促进肝纤维化,MafG/MYH9-LCN2信号通路可能是治疗肝纤维化的新靶点。
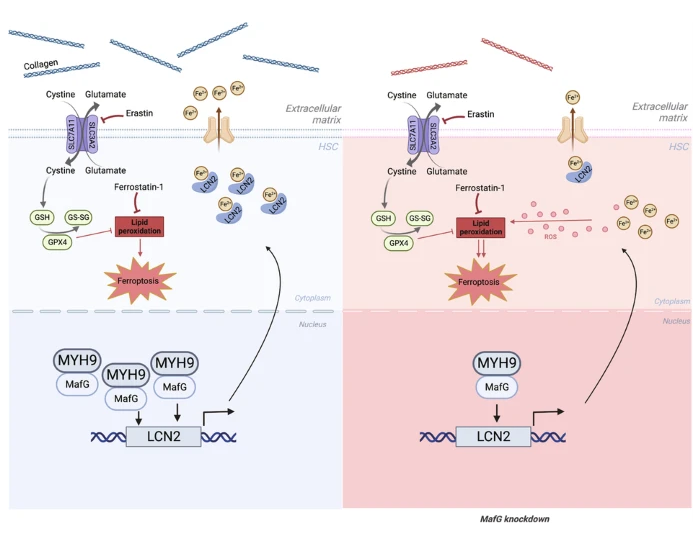
图3 MafG/MYH9-LCN2轴通过抑制HSC铁死亡促进肝纤维化
云克隆不仅可提供多种肝脏疾病动物模型,包括肝纤维化、肝缺血、酒精性肝病、肝内胆汁淤积、肝硬化、脂肪肝、肝功能衰竭等,涵盖常见肝脏疾病。还具有还具有多个物种肝星形细胞、肝窦内皮细胞、肝巨噬细胞、肝间充质干细胞等原代细胞产品和肝脏疾病常用检测指标及上述GPX4、DHODH、NRF2、CD36、NCF1、TLR4、LCN2等相关产品,可助力广大科研工作者进行肝脏疾病与铁死亡研究。
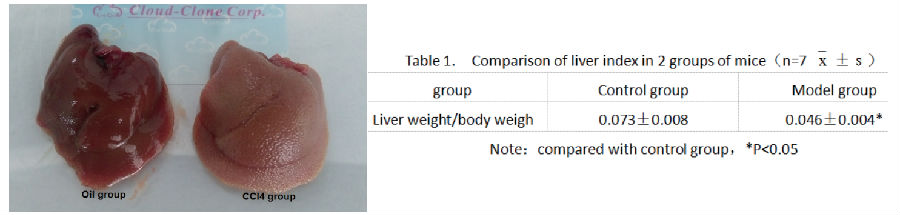
肝纤维化(HF)小鼠模型
建模方法:
按5ml/kg体重皮下注射体积分数为20%CCl4的油剂溶液(CCl4:橄榄油 =1:4), 每3天1次,连续6周。对照组动物皮下注射等量等次的橄榄油溶剂。正常饮食饲养,观察动物活动、精神状况和饮食量 , 实验前后称量小鼠体重。
完成持续给药6周后,称体重,麻醉小鼠,摘眼球取血,室温静置2h后于4℃, 3000r离心10分钟提取血清,放入-80℃冰箱冻存。同时取肝左叶组织 1.5cm×1cm×0.2cm 于 10% 中性福尔马林中固定,石蜡包埋;其余肝组织液氮或者-80℃冷冻保存。
肝缺血(HI)小鼠模型 建模方法: 1. 小鼠术前12h禁食,自由饮水。 2. 麻醉小鼠,麻醉成功后将小鼠平躺在手术台上胶带固定四肢,将小鼠腹部术去毛,用碘酒和75%乙醇术区消毒。 3. 取腹正中切口 1cm,打开腹腔,小心分离出肝脏供血的门静脉和肝动脉。 4. 用无创血管夹夹闭门静脉和肝动脉,0.5min 后,肉眼可见阻断叶明显变白,说明阻断成功,用止血钳夹闭皮肤切口临时关闭腹腔,同时将小鼠放在37℃恒温加热垫上保温。 5. 完成持续缺血60min后,重新打开腹腔,迅速取出血管夹,恢复缺血肝血流,0.5min左右可见缺血区肝脏由白色逐渐恢复为鲜红色表明再灌注成功,逐层缝合腹腔肌肉和皮肤关闭腹腔,完成手术。待小鼠清醒后放回饲养室饲养,密切关注小鼠的状态及生存状况并做好记录。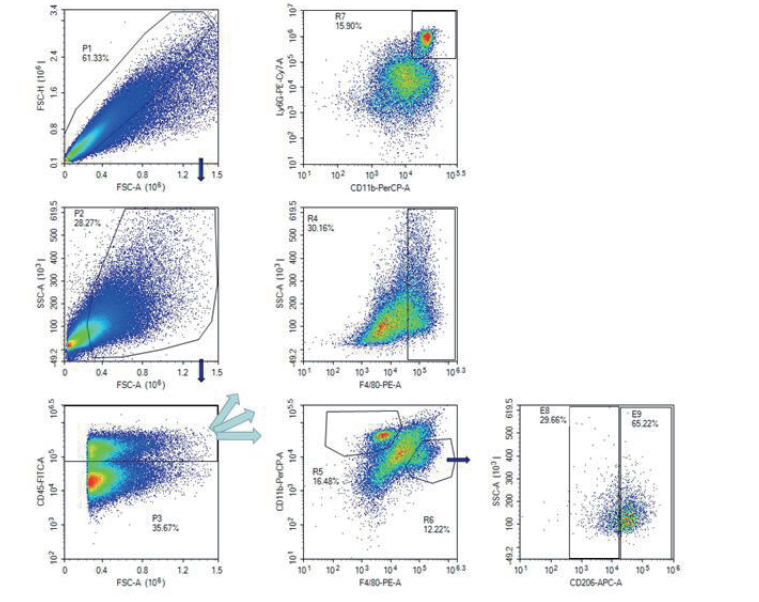
参考文献
[1]Lin H, Ma C, Zhuang X, et al. Sensing steroid hormone 17α-hydroxypregnenolone by GPR56 enables protection from ferroptosis-induced liver injury. Cell Metab. 2024;36(11):2402-2418.e10. (IF=27.7)
[2]Zhang J, Wang Y, Fan M, et al. Reactive oxygen species regulation by NCF1 governs ferroptosis susceptibility of Kupffer cells to MASH. Cell Metab. 2024;36(8):1745-1763.e6. (IF=27.7)
[3]Deng Y, Lu L, Zhu D, et al. MafG/MYH9-LCN2 axis promotes liver fibrosis through inhibiting ferroptosis of hepatic stellate cells. Cell Death Differ. 2024;31(9):1127-1139. (IF=13.7)