铁死亡:解码肠道疾病治疗新靶点的关键钥匙
铁死亡是一种铁依赖性、脂质过氧化驱动的调节性细胞死亡形式,其核心特征包括铁代谢紊乱、谷胱甘肽过氧化物酶4(GPX4)活性抑制、脂质过氧化物积累及线粒体膜结构破坏。近年研究发现,铁死亡与炎症性肠病(IBD)、溃疡性结肠炎(UC)、结直肠癌(CRC)等肠道疾病的发生发展密切相关,成为病理机制研究与治疗策略开发的新方向。在肠道疾病中,铁死亡的激活常与氧化应激和炎症反应相互交织。深入研究铁死亡与肠道微环境(如免疫细胞、神经内分泌网络)的交互机制,开发特异性调控靶点,并结合多组学技术探索个体化治疗策略,将是未来研究的重点。铁死亡作为连接代谢、氧化应激与细胞死亡的关键节点,有望为肠道疾病的精准干预开辟新路径。
1. NEDD4L介导肠上皮细胞铁死亡以限制炎症性肠病和结直肠肿瘤的发生
许多关键蛋白的功能丧失或增加会导致肠道稳态失调。浙江大学医学院附属第二医院Wenlong Lin团队的研究表明,NEDD4L,一种HECT家族E3泛素连接酶,在维持肠道稳态中起重要作用[1]。克罗恩病、UC和CRC患者的肠上皮细胞(IEC)中NEDD4L的表达受到显著抑制。NEDD4L敲除加剧了由硫酸葡聚糖钠(DSS)和2,4,6-三硝基苯磺酸(TNBS)诱导的结肠炎以及由偶氮甲烷和DSS诱导的CRC。从机制上讲,IEC中NEDD4L的缺乏通过降低SLC3A2的蛋白质表达而不影响其基因表达,从而抑制了关键铁死亡调节因子GPX4的表达,最终促进了DSS诱导的IEC铁死亡(图1)。此外,铁死亡抑制剂降低了NEDD4L缺陷小鼠对结肠炎和结肠炎相关CRC的易感性。因此,NEDD4L是IEC铁死亡的重要调节因子,维持肠道稳态,使其成为诊断和治疗IBD的潜在临床靶点。
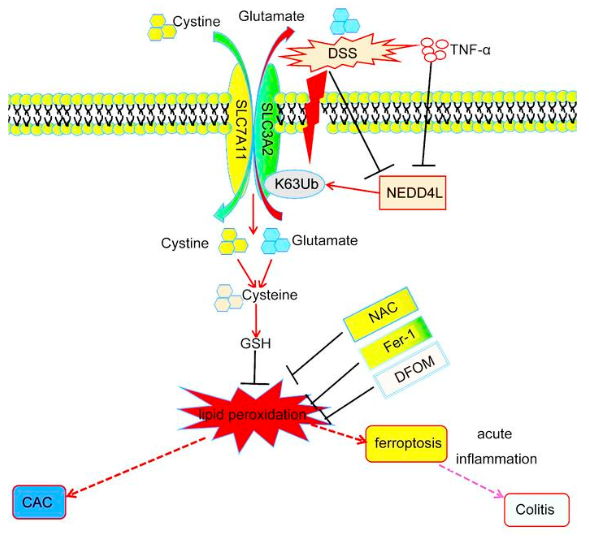
图1 NEDD4L介导IEC铁死亡以限制IBD和CRC发生
2. 铁死亡靶向口服给药系统用于放射性结肠炎治疗
放射性结肠炎是盆腔放疗患者腹泻和便血的主要原因。暨南大学化学与材料科学学院材料科学与工程系Mingxian Liu团队从铁死亡的角度探讨了放射性结肠炎的发病机制[2]。他们在埃洛石粘土纳米管外原位生长CeO2,管腔内负载铁死亡抑制剂去铁酮(DFP),制备含维生素E(VE)的稳定Pickering乳液(CeO2@HNTs@DFP@VE,命名为CHDV),通过抑制铁死亡来缓解放射性结肠炎。在CeO2能够清除活性氧,而DFP则可以缓解铁应激。这两种策略有效地抑制了脂质过氧化,挽救了肠道微环境中的铁死亡。埃洛石粘土纳米管在缓解结肠炎、通过静电吸附靶向炎症结肠以及作为乳液的界面稳定剂方面发挥着关键作用(图2)。这种基于铁死亡的策略在体外和体内均有效,为通过合理调节特定氧化应激来保护放疗提供了有前景的候选方案。
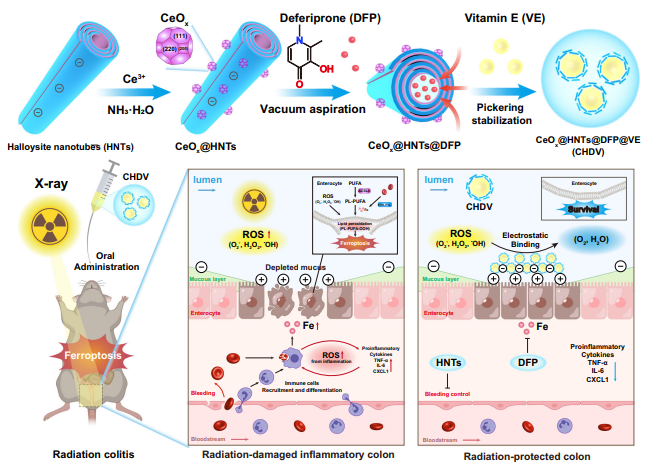
图2 CHDV Pickering乳剂的合成方法和治疗机理示意图
3. SELENOI在结肠炎和结直肠癌中作为铁死亡通路的关键调节因子
硒蛋白GPX4是铁死亡的关键调节因子。然而,目前尚不清楚是否还有其他硒蛋白参与铁死亡的调节,特别是在肠道疾病中。中国农业大学营养与健康系Jiaqiang Huang团队发现,硒蛋白I(Selenoi)通过维持醚脂质的稳态来预防铁死亡[3]。在IEC中特异性敲除Selenoi会诱导铁死亡的发生,导致肠道再生受损和结肠肿瘤生长受阻。从机制上讲,Selenoi缺乏会导致醚连接磷脂酰乙醇胺(ePE)显著减少,而醚连接磷脂酰胆碱(ePC)显著增加。ePE和ePC的失衡会导致磷脂酶A2,IIA型(Pla2g2a)和V型(Pla2g5)以及花生四烯酸15-脂氧合酶(Alox15)的上调,从而导致脂质过氧化过度。敲低PLA2G2A、PLA2G5或ALOX15可以逆转铁死亡表型,表明它们是SELENOI的下游效应器。GPX4过表达无法挽救SELENOI敲低细胞的铁死亡表型,而SELENOI过表达则能部分挽救GPX4敲低诱导的铁死亡(图3)。这表明SELENOI防止铁死亡不依赖于GPX4。这些发现有力地支持了SELENOI在结肠炎和结肠肿瘤发生过程中作为铁死亡抑制因子发挥作用的观点。
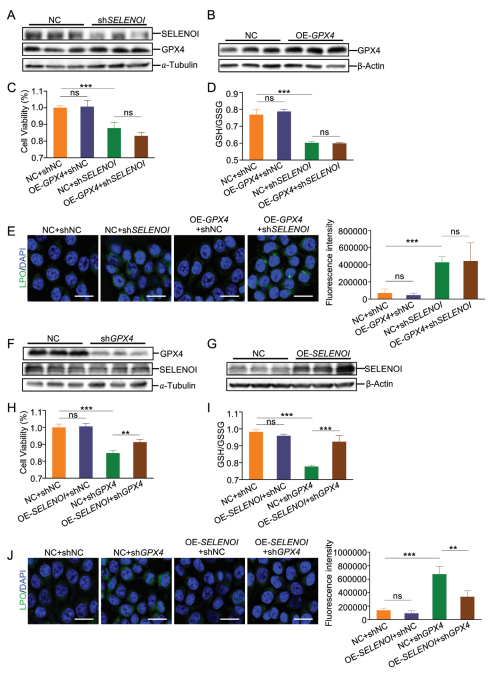
图3 SELENOI过表达显著减轻GPX4抑制诱导的体外铁死亡
云克隆不仅可提供肠易激综合征、克罗恩病、溃疡性结肠炎、胃溃疡、胃炎、十二指肠溃疡等常见消化疾病动物模型,还具有多个物种肠成纤维细胞、结肠上皮细胞、结肠平滑肌细胞等原代细胞和各类肠胃疾病检测指标及上述GPX4、SLC3A2、Alox15等相关产品,可助力广大科研工作者进行铁死亡和肠道疾病相关研究。
相关动物模型
肠易激综合征(IBS)大鼠模型
建模方法:

结肠炎小鼠模型 建模方法: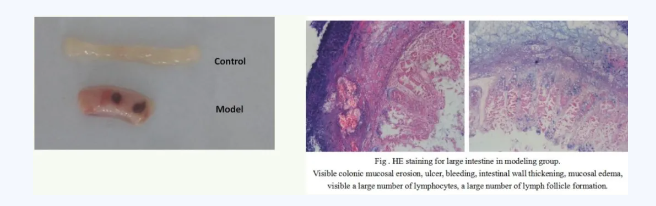
参考文献
[1] Liang J, Wang N, Yao Y, et al. NEDD4L mediates intestinal epithelial cell ferroptosis to restrict inflammatory bowel diseases and colorectal tumorigenesis. J Clin Invest. 2024;135(3):e173994. (IF=13.3)
[2] Feng Y, Luo X, Li Z, et al. A ferroptosis-targeting ceria anchored halloysite as orally drug delivery system for radiation colitis therapy. Nat Commun. 2023;14(1):5083. (IF=14.7)
[3] Huang X, Yang X, Zhang M, et al. SELENOI Functions as a Key Modulator of Ferroptosis Pathway in Colitis and Colorectal Cancer. Adv Sci (Weinh). 2024;11(28):e2404073. (IF=14.3)