铁死亡:破解神经退行性疾病的氧化密码 —— 从铁稳态失衡到靶向治疗新纪元
铁死亡是铁和脂质过氧化介导的调节细胞死亡的一种形式。最近的证据强烈表明,铁死亡与各种神经退行性疾病(ND)有关,特别是阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病(HD)、多发性硬化症(MS)和肌萎缩侧索硬化症(ALS)等。在健康大脑中,铁参与多种关键生理过程,如髓鞘形成、神经递质合成和抗氧化酶功能。铁代谢受到严格调控,以确保其在细胞内维持安全水平。然而,在衰老、炎症和氧化应激的条件下,铁稳态易被打破,导致铁超载。铁超载会通过诱导脂质过氧化反应,产生过量的自由基,进而损伤细胞膜和细胞器,最终导致细胞死亡,即铁死亡。针对铁死亡的治疗策略成为神经退行性疾病研究的新方向。铁螯合剂、抗氧化剂等已被证实能在动物模型中减缓神经退行性疾病的进展。铁死亡为理解神经退行性疾病的病理机制提供了新视角,靶向铁死亡的治疗策略显示出潜在的应用前景。
1. 利用工程DFO纳米片靶向不稳定铁池抑制PD治疗中的铁死亡
神经元铁死亡被认为是诱发PD的关键因素之一,帕金森病是由细胞内不稳定铁池(LIP)中过量铁积累引起的。LIP释放的铁离子导致活性氧(ROS)的异常产生,从而引发铁死亡并加剧PD进展。贵州医科大学地方病与民族病重点实验室Chunlin Zhang团队设计了一种多功能纳米调节剂去铁胺(DFO)集成纳米片(BDPR NS),该纳米片靶向LIP以限制铁死亡并预防PD[1]。这些BDPR-NS可以螯合游离铁离子,从而改善LIP过载并调节铁代谢。此外,BDPR NS可以通过减轻ROS的积累来减少脂质过氧化的产生。更重要的是,BDPR NS可以特异性地在线粒体中积累,以抑制ROS的产生并减少线粒体铁的积累。体内实验表明,BDPR-NS通过调节LIP和抑制铁死亡,高效地减轻了多巴胺能神经元的损失及其相关的行为障碍(图1)。因此,基于BDPR的纳米载体有望成为推进PD治疗的潜在途径。
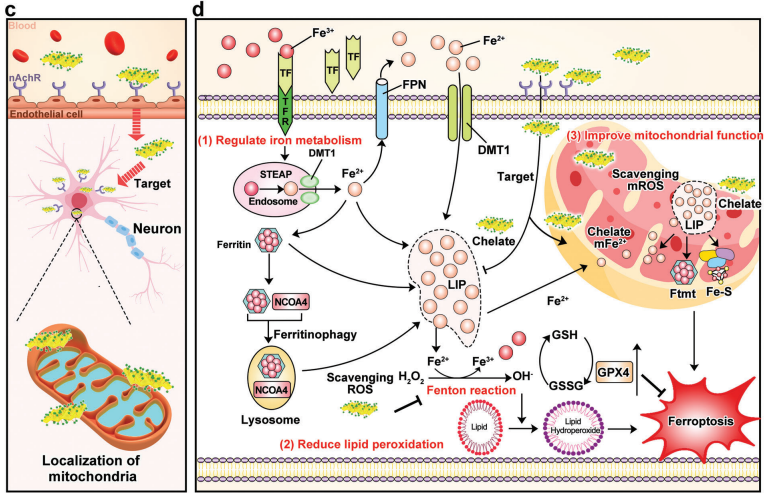
图1 使用BDPR NS进行PD治疗的示意图
2. 聚多酚抑制铁死亡并调节tau液液相分离以减轻AD
AD其中一种致病机制涉及tau的液-液相分离(LLPS),有助于形成致病性tau聚集体;另一种机制是铁死亡。目前缺乏同时针对淀粉样蛋白毒性和铁死亡的治疗策略。印度贾瓦哈拉尔·尼赫鲁高级科学研究中心Thimmaiah Govindaraju团队探讨聚多酚,分别由多巴胺和左旋多巴组成的PDP和PLDP作为多功能药物调节铁死亡和AD之间的病理联系的潜力[2]。聚多酚可以隔离不稳定铁池(LIP),抑制Aβ和tau聚集,清除自由基,保护线粒体,防止铁死亡,从而挽救神经元细胞死亡(图2)。此外,PLDP促进tau LLPS,并调节其分子间相互作用以抑制有毒tau聚集体的形成,为治疗tau蛋白病提供了一种概念上的创新方法。
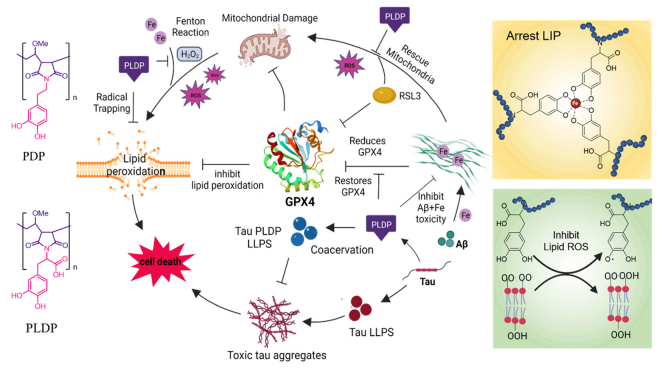
图2 PLDP通过抑制Aβ42聚集来调节铁死亡和淀粉样蛋白毒性
3. SPY1通过调节GCH1和TFR1减少脂质过氧化,抑制ALS中的神经元铁死亡
作为铁死亡的关键调节因子,谷胱甘肽过氧化物酶4(GPX4)已被证明在ALS中下调。然而,ALS铁死亡的机制尚不清楚。哈尔滨医科大学第一附属医院神经内科Honglin Feng团队发现ALS、铁死亡与Speedy/RINGO细胞周期调节因子家族成员A(SPY1)之间存在高度相关性[3]。SPY1是一种“细胞周期蛋白样”蛋白,已被证明可以通过抑制DNA损伤来提高hSOD1G93A细胞的存活率。ALS中SPY1表达的降低是由MDM2(一种核定位的E3泛素连接酶)介导的泛素化降解引起的。此外,SPY1被鉴定为一种新型的铁死亡抑制剂,可减轻由失调的GCH1/BH4轴(铁死亡的抗性轴)和转铁蛋白受体蛋白1(TFR1)诱导的铁引起的脂质过氧化(图3)。此外,SPY1的神经元特异性过表达通过上述两种途径显著延迟了ALS转基因小鼠的发生并延长了存活时间。这些结果表明,SPY1是铁死亡和ALS的新靶点。

图3 SPY1在hSOD1G93A小鼠中通过抵抗神经元铁死亡起保护作用
云克隆不仅可提供多种神经系统疾病动物模型,包括帕金森、阿尔兹海默症、焦虑症、慢性应激抑郁等,涵盖常见神经系统疾病。还具有多个物种海马神经元细胞、脑干神经元细胞、大脑皮层神经元细胞、神经小胶质细胞、脑星形胶质细胞等原代细胞,以及各类神经系统疾病和铁死亡检测指标与上述GCH1、TFR1、GPX4、MDM2等相关产品,可助力广大科研工作者进行铁死亡与神经系统疾病相关研究。
相关动物模型
帕金森病(PD)小鼠模型
建模方法:

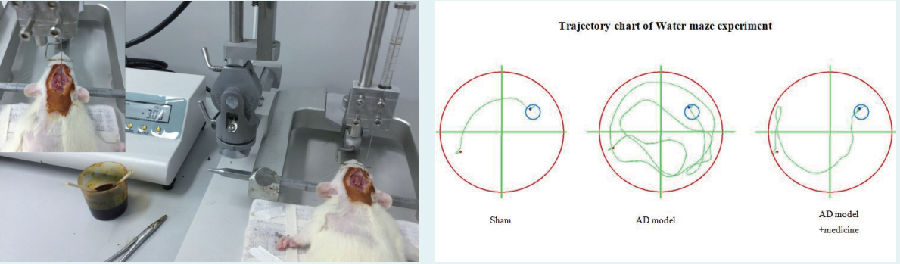
阿尔茨海默病(AD)大鼠模型
建模方法:
麻醉大鼠,麻醉后继而固定于脑立体定位仪上。按照大鼠脑立体定位图谱,以前囟为零起点,前囟后3.5mm处为穿刺点,中线右侧旁开2mm,而后牙科钻钻开颅骨,采用微量注射器自脑表面垂直进针3mm,即:(AP=-3.5mm, ML=2.0mm, DV=3.0mm),双侧海马CA1区缓慢匀速注射Aβ1-40各10μg(1μL),留针5min,退针后缝合伤口。造模后3d后,开始尾静脉注射,注射生理盐水,大鼠每只给药100μl/次/d,连续给药21d后,进行水迷宫行为学检测。
参考文献
[1]Lei L, Yuan J, Dai Z, et al. Targeting the Labile Iron Pool with Engineered DFO Nanosheets to Inhibit Ferroptosis for Parkinson's Disease Therapy. Adv Mater. 2024;36(41):e2409329. (IF=27.4)
[2]Moorthy H, Ramesh M, Padhi D, Baruah P, Govindaraju T. Polycatechols inhibit ferroptosis and modulate tau liquid-liquid phase separation to mitigate Alzheimer's disease. Mater Horiz. 2024;11(13):3082-3089. (IF=12.2)
[3]Wang D, Liang W, Huo D, et al. SPY1 inhibits neuronal ferroptosis in amyotrophic lateral sclerosis by reducing lipid peroxidation through regulation of GCH1 and TFR1. Cell Death Differ. 2023;30(2):369-382. (IF=13.7)