癌症治疗新策略:脂肪细胞改造后移植
2025年2月4日,美国加州大学旧金山分校的研究团队在《Nature Biotechnology》上发表了题为“Implantation of engineered adipocytes suppresses tumor progression in cancer models”的研究论文,他们开发了一种肿瘤治疗方法——脂肪操控移植(AMT),即通过基因工程改造脂肪细胞后进行移植,使这些细胞能够与肿瘤细胞竞争营养物质,从而抑制肿瘤生长。

研究人员期望通过基因编辑将常见的白色脂肪转化为具有高代谢能力的棕色脂肪,从而与肿瘤细胞竞争营养,实现抑制肿瘤的目的,这一方法的实现有望解决棕色脂肪数量少、获取难及寒冷环境刺激棕色脂肪不适于临床应用的问题。他们开发了一种方法,即利用CRISPRa(CRISPR激活)技术使脂肪细胞中的特定基因(如UCP1、PPARGC1A和PRDM16)表达上调,从而使这些脂肪细胞具备棕色脂肪的代谢特点,被称为“棕色化脂肪细胞”,这种棕色化脂肪细胞具有更强的葡萄糖摄取和脂肪酸氧化能力。
研究人员首先从人脂肪细胞中分离出前脂肪细胞,使用含有3-异丁基-1-甲基黄嘌呤、地塞米松和胰岛素等成分的分化培养基进行诱导分化。同时构建针对UCP1、PPARGC1A或PRDM16基因启动子的引导RNA(gRNA),并与dCas9-VP64转录激活因子融合,将构建的融合体克隆到腺相关病毒(AAV)表达载体中,然后用CRISPRa-AAV感染脂肪细胞,以构建棕色化脂肪细胞。研究人员将经CRISPRa改造获得的棕色化脂肪细胞分别与五种不同的肿瘤细胞系进行共培养,发现这五种肿瘤细胞的增殖均受到抑制,其中UCP1基因表达上调的棕色化脂肪细胞抑制效果最显著。经CRISPRa改造的棕色化脂肪细胞降低了肿瘤细胞的代谢能力,葡萄糖摄取和糖酵解、脂肪酸摄取和氧化水平明显下降。在MCF-7细胞模型中,棕色化脂肪细胞对肿瘤细胞代谢的抑制效果可以媲美,甚至优于现有代谢型癌症药物(如6-AN和Etomoxir),表明这一方法作为抗癌治疗的巨大潜力。(图1)

图1. CRISPRa改造的脂肪细胞在体外抑制肿瘤细胞生长
图片源于《Nature Biotechnology》
研究人员采用三维培养技术培养前脂肪细胞,并进行分化诱导。随后,使用CRISPRa-AAV感染这些脂肪细胞,以上调UCP1、PPARGC1A和PRDM16基因的表达,从而构建出棕色化脂肪类器官。将构建的棕色化脂肪类器官植入异种移植肿瘤小鼠模型体内,与对照组相比,植入的棕色化脂肪类器官显著减小了肿瘤体积,同时有效降低了肿瘤细胞的代谢和增殖水平,并增加了肿瘤细胞的凋亡。这些结果表明,该技术在体内可有效抑制肿瘤生长。(图2)
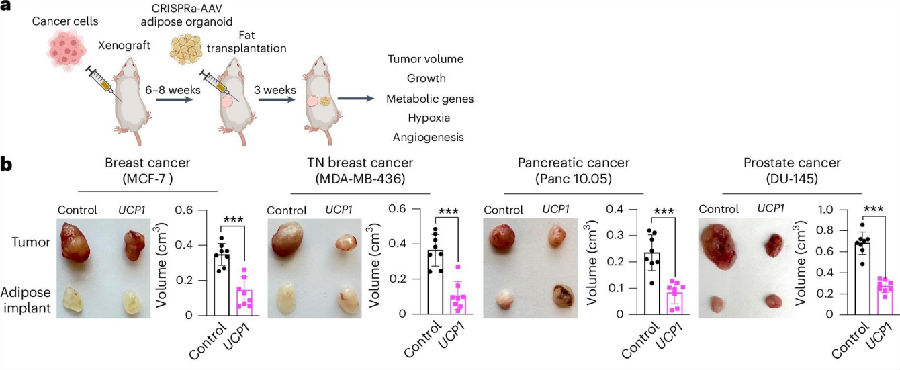
图2. UCP1-CRISPRa改造的脂肪类器官组织在体内可抑制异种移植肿瘤
图片源于《Nature Biotechnology》
研究人员进一步发现,CRISPRa改造后的脂肪类器官能提高小鼠的全身耗氧量、葡萄糖耐量和胰岛素敏感性,证实了这些改造后的器官能够增加能量消耗。研究人员通过使用不同饲料喂养小鼠,发现标准饲料喂养的小鼠体内CRISPRa改造的脂肪类器官能够显著减小肿瘤体积并降低肿瘤细胞代谢水平;然而,在高脂或高糖饲料喂养的小鼠体内,肿瘤体积和细胞代谢水平未见明显变化。RNA-seq分析结果显示,标准饲料喂养的小鼠肿瘤中代谢调节基因的表达量有所下调。这些结果表明,高脂肪酸或葡萄糖水平会削弱CRISPRa改造脂肪类器官对肿瘤的抑制作用。证实CRISPRa改造的脂肪类器官通过增强对营养物质的摄取和代谢,从而抑制肿瘤生长,且在竞争葡萄糖和脂肪酸方面,其能力优于肿瘤细胞。(图3)

图3. 增加营养会降低CRISPRa改造的脂肪类器官对肿瘤抑制作用
图片源于《Nature Biotechnology》
为探究CRISPRa改造的脂肪类器官对肿瘤发展的预防效果,研究人员在胰腺癌和乳腺癌遗传小鼠模型中植入了这些CRISPRa改造的脂肪类器官。与对照组相比,植入CRISPRa改造的脂肪类器官的小鼠体内肿瘤体积的显著减小,降低了肿瘤增殖能力和代谢基因表达水平,减少血管生成,并促进肿瘤细胞凋亡。这些发现表明CRISPRa改造的脂肪类器官在抑制肿瘤发展方面可能具有系统性治疗潜力。(图4)
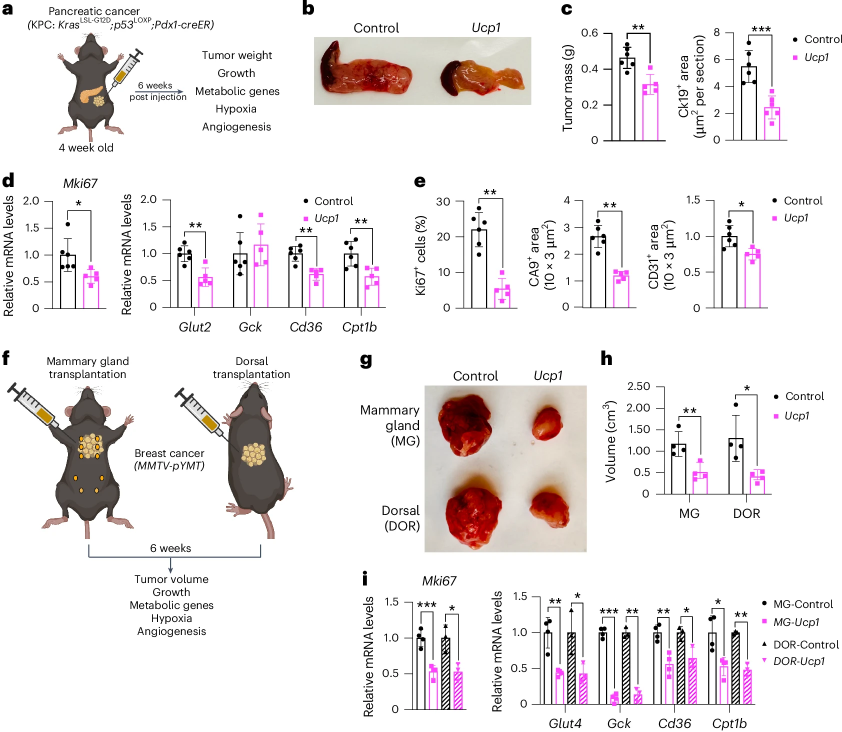
图4. 在胰腺癌和乳腺癌遗传小鼠模型中植入CRISPRa改造脂肪类器官可抑制肿瘤发展
图片源于《Nature Biotechnology》
为评估这一方法的治疗潜力,研究人员提取了乳腺癌患者的脂肪细胞,并运用CRISPRa技术对其进行改造,然后与乳腺癌细胞类器官共培养并进行检测。实验结果表明,经CRISPRa改造的脂肪细胞在体外和小鼠体内均能抑制乳腺癌细胞的生长。特别是在与携带乳腺癌风险相关基因BRCA1、BRCA2或RAD51D突变的乳腺类器官共培养时,乳腺类器官的增殖相关基因表达下降,表明其对遗传性癌前细胞具有一定抑制能力。这些发现为预防癌症高风险个体癌症的发展提供了新的治疗策略。(图5)
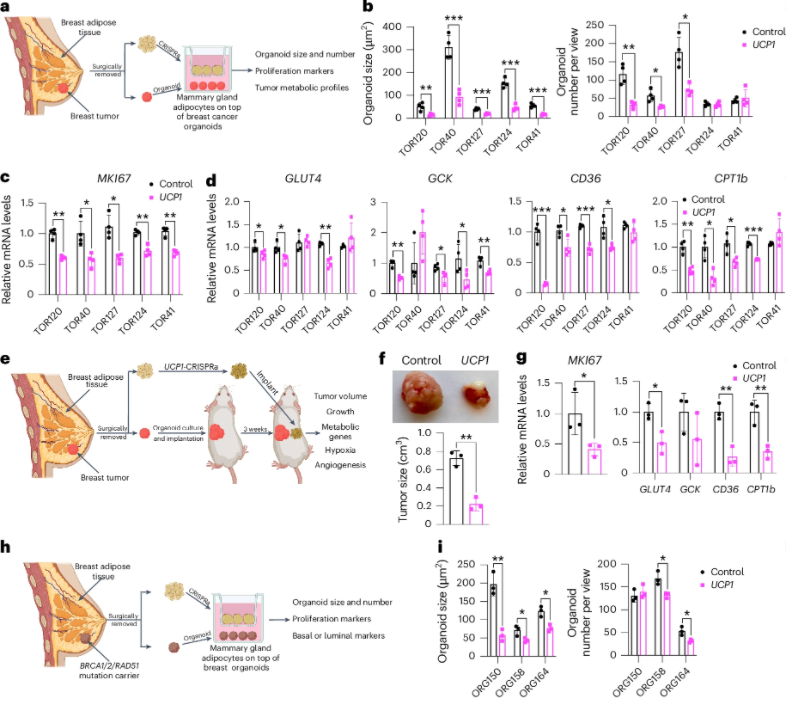
图5. 肿瘤类器官与CRISPRa改造的脂肪细胞共培养可抑制肿瘤并预防癌症发生
图片源于《Nature Biotechnology》
研究人员还建立了聚己内酯制作的细胞支架的AMT系统,以便更精准地针对特定肿瘤进行治疗。细胞支架易于从患者体内移除或替换,从而可以更精确地控制治疗剂量;此外,还可以控制移植细胞的排列,优化其与肿瘤细胞的相互作用;细胞支架可以充当屏障,减少移植细胞与宿主免疫系统之间的直接接触,从而降低免疫排斥反应的风险。
AMT新疗法在体外实验和小鼠模型中均显示出显著疗效,这种方法操作简单,并且使用自体细胞进行改造后植入,排异反应降低,还可以根据患者具体情况进行个性化定制,适用于多种癌症类型,具有巨大的临床应用潜力。然而,该方法依然存在一些缺陷,比如可能该方法可能会导致患者体重下降,CRISPRa技术的精确性不够高等,因此仍然需要进行更多的临床验证来确保该方法可以安全使用。
云克隆公司助力科学研究,为广大科研人员提供相关检测试剂产品,相关靶标核心货号如下
靶标 | 核心货号 | 靶标 | 核心货号 |
UCP1 | F557 | PPARGC1A | H337 |
PRDM16 | P333 | UPP1 | E811 |
HK2 | D352 | GLUT1 | B185 |
GLUT4 | C023 | CD36 | B530 |
FASN | C470 | SCD1 | F419 |
TFAM | H050 | DIO2 | C903 |
NRF1 | C669 | GCK | A667 |
CD31 | A363 | CA9 | D076 |
Ki-67 | C047 | CASP3 | A626 |
MTOR | B806 | CK5 | A488 |
CK17 | B822 |
更多科研试剂,欢迎访问云克隆官方网站:http://www.cloud-clone.cn/