铁死亡:引爆炎症的'分子开关'?解码细胞死亡与免疫风暴的双向暗战
铁死亡作为一种新型程序性细胞死亡方式,与炎症反应之间存在着复杂的双向调控关系。这种铁依赖性的细胞死亡模式通过脂质过氧化驱动,其独特的分子机制为理解炎症性疾病提供了全新视角。铁死亡细胞释放的损伤相关分子模式(DAMPs)是启动炎症反应的关键介质。HMGB1蛋白通过TLR4受体激活巨噬细胞,释放IL-6、TNF-α等促炎因子。脂质过氧化终产物MDA和4-HNE可直接修饰蛋白质,形成具有免疫原性的新表位。铁死亡引发的氧化微环境还能激活NLRP3炎症小体,促进IL-1β等细胞因子的成熟释放。越来越多的实验证实了铁死亡在炎症中的积极作用,并且几种化合物已显示出作为铁死亡抑制剂的抗炎作用。因此,针对铁死亡与炎症的相互作用网络的精准调控策略可能为慢性炎症性疾病治疗带来突破性进展。
1. 铁死亡促进和延长果蝇的炎症反应
铁死亡在多种病理中对器官损害有重要作用。然而,由于缺乏特异性探针,铁死亡在体内尚未被可视化,这严重限制了对免疫系统如何与铁死亡细胞相互作用以及这一过程如何促进炎症的研究。英国爱丁堡大学再生与修复研究所Will Wood团队通过三色活体成像技术展示,在果蝇胚胎受伤期间,铁死亡样坏死是急性损伤的关键组成部分[1]。他们进一步证明,胚胎内的巨噬细胞会迅速与这些坏死细胞接触,但难以将其吞噬,导致长时间的、受损的吞噬作用以及频繁的细胞残骸分解。相反,在受伤过程中抑制铁死亡程序会延迟巨噬细胞向损伤部位的募集,这表明铁死亡在体内炎症过程中具有相互矛盾的作用(图1)。这些结果提示铁死亡在急性损伤中的作用具有两面性。一方面,它能强烈引发炎症,帮助组织应对损伤;另一方面,铁死亡本身难以清除,且容易受到起反作用的细胞残骸分解的影响,无疑会妨碍炎症的消退。
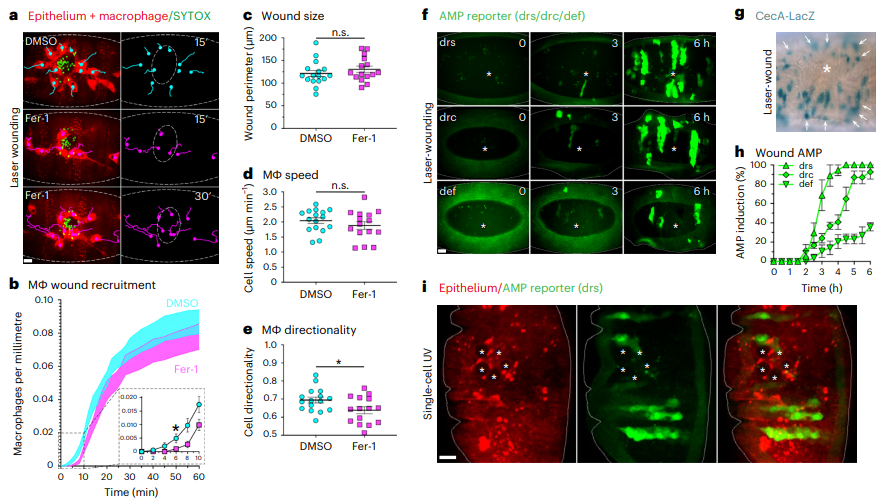
图1 铁死亡性坏死在炎症组织损伤中的作用
2. 通过自由基捕获手性聚合物胶束减轻不受控制的炎症
不受控制的炎症的特征是氧化应激与炎症反应之间的相互作用。铁死亡细胞在不受控制的炎症中起着关键作用。因此,抑制铁死亡能够控制过度炎症,但小分子抑制剂在细胞膜中的停留时间较短。为了解决这一挑战,天津大学药物科学与技术学院Yanjun Zhao团队通过模仿嵌入螺旋蛋白的细胞膜结构,设计了手性自由基捕获聚合物[2]。这些聚合物被调整为呈现α-螺旋构象,从而提高了疏水性、延长了膜保留时间,并增强了脂质自由基捕获能力(图2)。手性聚合物具有两亲性,自组装形成的胶束表现出延长的血液循环。在脂多糖诱导的巨噬细胞和小鼠模型中,手性聚合物胶束有效地抑制了铁死亡并抑制了炎性细胞因子。这项研究为通过抗铁死亡减轻不受控制的炎症提供了一种创新手段。
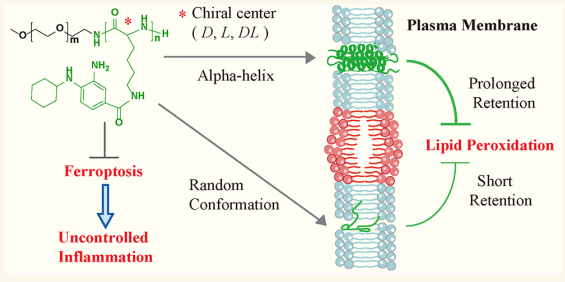
图2 手性聚合物胶束通过延长膜保留和增强自由基清除来减少炎症和抑制铁死亡
3. NINJ1在铁死亡过程中诱导质膜破裂和DAMPs的释放
铁死亡是一种由铁依赖性氧化磷脂在细胞膜中积累所引发的受调控的坏死性细胞死亡,最终导致质膜破裂(PMR)和细胞溶解。然而,铁死亡相关的PMR是否也由蛋白质主动执行或由渗透压驱动尚不清楚。瑞士洛桑埃帕林格斯大学免疫生物学系Petr Broz团队研究了 ninjurin-1(NINJ1)在铁死亡中的潜在作用[3]。NINJ1在铁死亡过程中发生寡聚化,并且Ninj1缺陷可保护巨噬细胞和成纤维细胞免受铁死亡相关的PMR(图3)。从机制上讲,NINJ1对铁死亡的初始步骤(如脂质过氧化、通道介导的钙内流和细胞肿胀)并非必需。相反,NINJ1对早期质膜完整性的丧失是必需的,这发生在完全PMR之前。此外,NINJ1介导铁死亡细胞释放胞质蛋白和损伤相关分子模式(DAMP)分子,这表明靶向NINJ1可能是减轻铁死亡相关炎症的一种治疗选择。
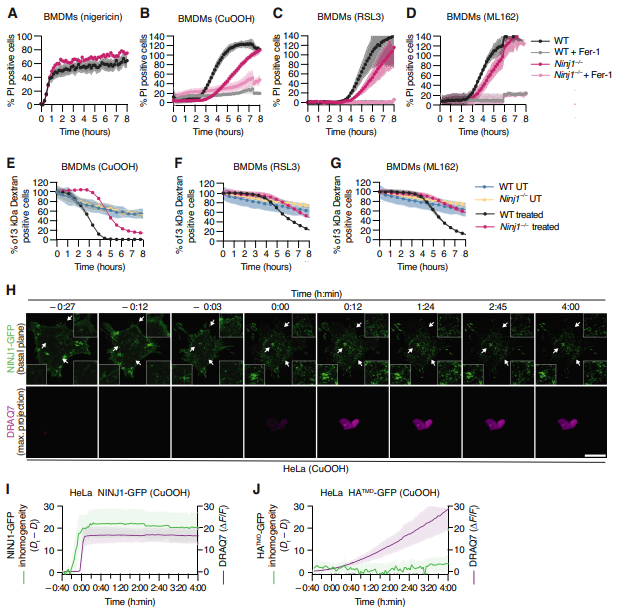
图3 NINJ1调控巨噬细胞和成纤维细胞铁死亡时的质膜通透性
云克隆不仅可提供多种炎症性疾病动物模型,包括结肠炎、类风湿关节炎、骨关节炎、胰腺炎、肾炎等,涵盖常见炎症性疾病。还具有各类炎症性疾病和铁死亡检测指标及上述HMGB1、TLR4、NLRP3、NINJ1等相关产品,可助力广大科研工作者进行铁死亡与炎症性疾病相关研究。
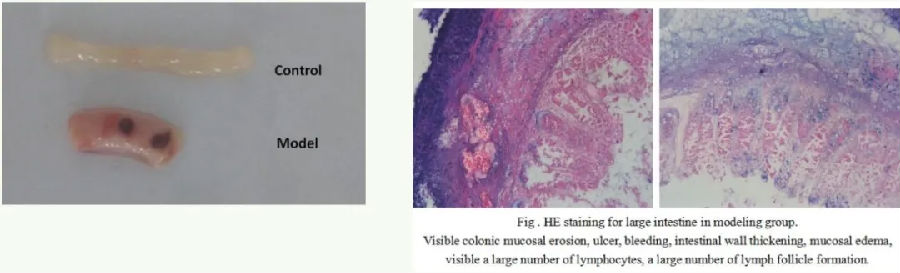
结肠炎小鼠模型
建模方法:
1. 小鼠术前12 h禁食,自由饮水。
2. 麻醉小鼠,小鼠取头低尾高体位,将聚乙烯导管经肛门缓慢插入结肠3cm并经其注入5%乙酸0.4 mL,捏紧小鼠肛门倒提30 s后,注入生理盐水lmL冲洗,正常组注入等量生理盐水对照,造模结束后让小鼠平躺,自然清醒,常规饲养。
3. 7d后摘眼球取血,静止30min,4℃离心机3000r/min离心10min,分离出上层血清,置-80℃冰箱保存备用。取小鼠肛门至盲肠末端的整个结肠和直肠段,预冷生理盐水冲洗干净,滤纸吸干,肉眼观察各组小鼠结肠的大体改变,测量结肠长度及记录湿重。剪取病变最严重的结肠1cm,4%多聚甲醛固定,石蜡包埋切片(厚4um),HE染色。观察病理改变,其余结肠置于-80℃冰箱备用。
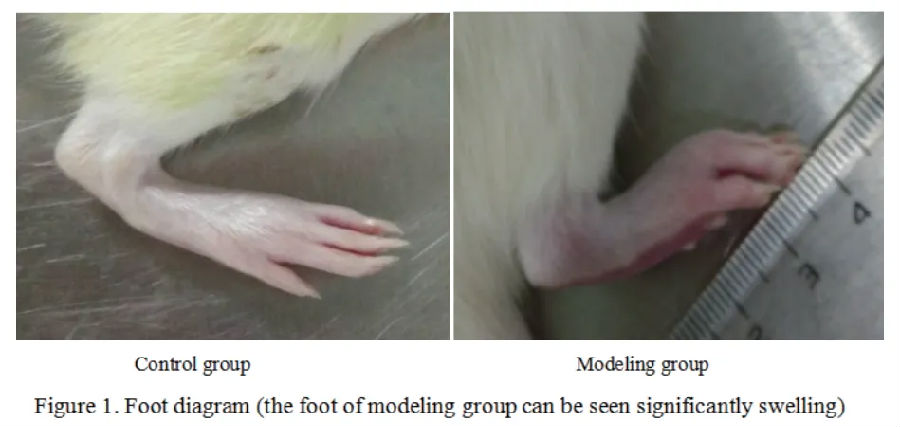
类风湿关节炎(RA)大鼠模型
建模方法:
麻醉大鼠,于右后足皮内注射 0.1mL完全弗氏佐剂(CFA)致炎,从而建立大鼠佐剂性关节炎模型;对照组右后足趾皮下注射0.01mol/L冰醋酸0.1mL,以排除CFA中溶剂的致敏效应。
参考文献
[1] Davidson AJ, Heron R, Das J, Overholtzer M, Wood W. Ferroptosis-like cell death promotes and prolongs inflammation in Drosophila. Nat Cell Biol. 2024;26(9):1535-1544. (IF=17.3)
[2] Li Y, Wang J, Li Y, et al. Attenuating Uncontrolled Inflammation by Radical Trapping Chiral Polymer Micelles. ACS Nano. 2023;17(13):12127-12139. (IF=15.8)
[3] Ramos S, Hartenian E, Santos JC, Walch P, Broz P. NINJ1 induces plasma membrane rupture and release of damage-associated molecular pattern molecules during ferroptosis. EMBO J. 2024;43(7):1164-1186. (IF=9.4)