降糖降脂新发现——肝脏ALKBH5通过GCGR和mTORC1信号独立调节葡萄糖和脂质稳态
维持葡萄糖和脂质稳态对健康至关重要,其失调会导致诸如2型糖尿病(T2DM)和代谢功能障碍相关的脂肪性肝病(MAFLD)等代谢疾病。RNA结合蛋白(RNA-binding proteins,RBPs)在多种RNA加工活动中发挥着关键作用。越来越多的证据表明,某些RBPs在调节葡萄糖和脂质稳态方面具有重要作用,从而影响代谢性疾病的发病机制。然而,RBPs在葡萄糖和脂质稳态的综合调节中作为代谢性疾病关键驱动因素的潜力仍未得以全面探索。本研究发现烷基化修复同源蛋白5(ALKBH5)是代谢性疾病的主要调节因子。肝细胞特异性缺失Alkbh5通过抑制胰高血糖素受体(GCGR)和哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)信号通路来降低葡萄糖和脂质。靶向敲低肝脏Alkbh5可逆转糖尿病小鼠的T2DM和MAFLD,突出其治疗潜力。
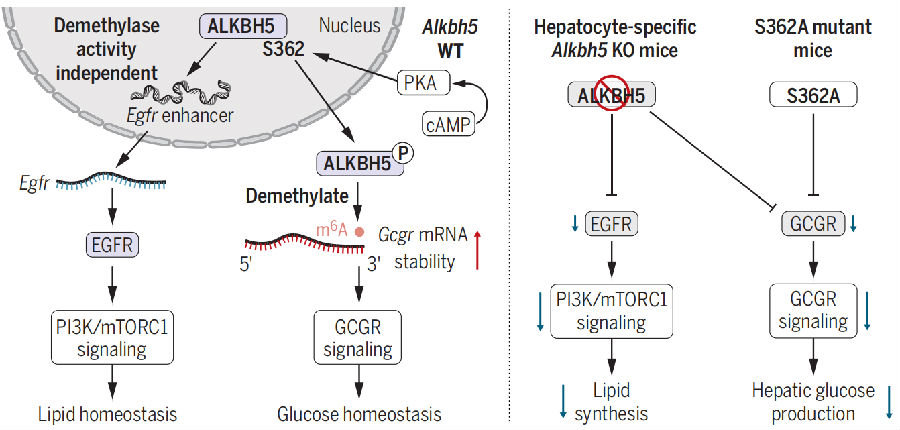
图1. 肝脏中ALKBH5调节葡萄糖和脂质稳态
(图片源自《Science》)
db/db BKS小鼠是代谢性疾病(包括肥胖症、T2DM、MAFLD和高脂血症)研究中广泛使用的模型。为了鉴定db/db小鼠肝脏中差异表达的RNA结合蛋白(RBPs),作者对其进行了定量蛋白质组学分析。发现了7个上调表达的RBPs,其中两个含有与调控肝脏糖异生相关的RRXS/T基序。结合已发表的大小鼠肝脏中磷酸化蛋白质组学数据集综合分析发现,只有上调的ALKBH5,一种关键的RNAN6-甲基腺苷(m6A)去甲基化酶属于RBPs。
WB结果证实,db/db小鼠、高脂饮食(HFD)诱导的肥胖小鼠以及人类糖尿病肝脏中ALKBH5蛋白表达量和正常对照相比显著升高。后续作者就把研究重点转向ALKBH5。他们分析发现ALKBH5中有两个RRXS基序,包含Ser253和Ser362。然而,肝脏和肝细胞样本的磷酸化蛋白质组学数据中仅检测到Ser362的磷酸化,这表明Ser362是ALKBH5发挥作用的关键。由于ALKBH5在肝脏中的表达量高于其他代谢组织。这些信息表明,ALKBH5可能调节肝脏的葡萄糖和脂质稳态。
随后,作者利用CRISPR/Cas9技术生成了S362A点突变小鼠来研究Ser362磷酸化是否对ALKBH5增强肝葡萄糖生成(HGP)的作用至关重要。作者发现虽然S362A小鼠和WT小鼠体重相当,但S362A小鼠的空腹血糖水平较低,并且对HFD诱导的高血糖具有保护作用。此外,S362A小鼠的葡萄糖耐量得到改善,并且对HFD诱导的葡萄糖耐受不良具有保护作用。在正常饲料(NC)饮食和HFD条件下,S362A小鼠的曲线下面积(Area Under Curve,AUC)均降低。这些发现强调了ALKBH5作为肝葡萄糖生成的正向调节因子的作用,突出了Ser362磷酸化在其调节功能中的重要性。
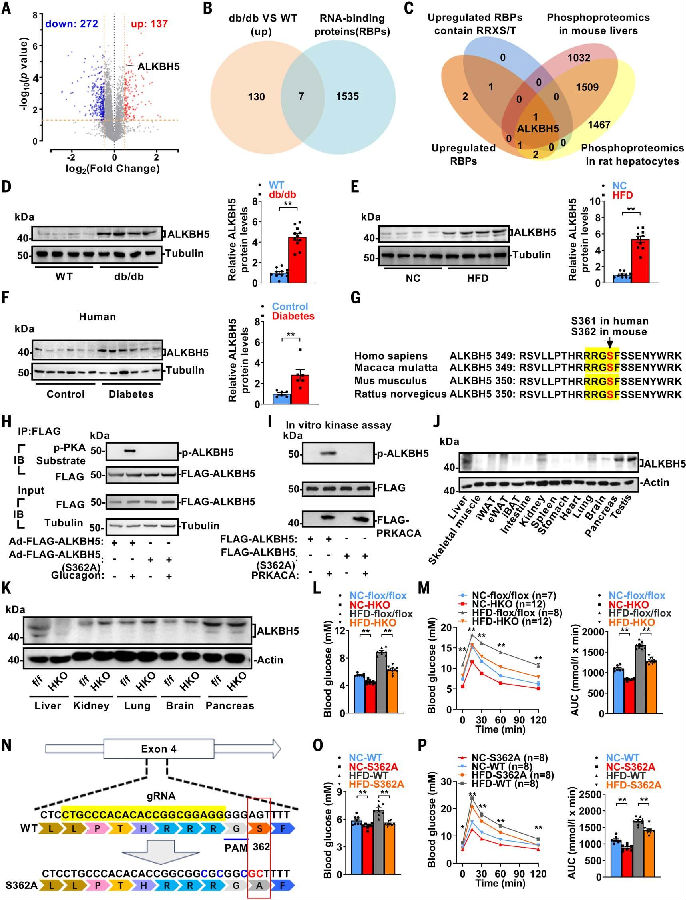
图2. 定量蛋白质组学分析确定ALKBH5是代谢疾病的关键调节因子
(图片源自《Science》)
为了探究肝脏中ALKBH5在代谢调节和疾病中的作用,作者构建了肝细胞特异性Alkbh5基因敲除小鼠(Alkbh5-HKO)用于后续实验。作者将研究重点放在了胰高血糖素-GCGR-cAMP-PKA-CREB信号通路上。雄性Alkbh5flox/flox小鼠和Alkbh5-HKO小鼠的血清胰岛素水平相似。然而,在NC和HFD条件下,Alkbh5-HKO小鼠肝脏中的GCGR、cGMP、磷酸化PKA(p-PKA)底物以及磷酸化CREB(p-CREB)水平均降低。此外,Gcgr和糖异生相关的基因在Alkbh5-HKO小鼠肝脏中的表达量均有所下降。同样,S362A突变削弱了GCGR-cAMP-PKA-CREB信号通路,并降低了S362A小鼠中糖异生相关基因的表达。这些发现表明,ALKBH5及其在Ser362位点的磷酸化在维持GCGR-cAMP-PKA-CREB信号通路中起关键作用。
随后,为了明确GCGR减少在Alkbh5-HKO小鼠中的降糖作用,作者进行了挽救实验。在Alkbh5-HKO小鼠中恢复GCGR表达后,小鼠中血糖水平升高,葡萄糖耐受量、乳酸诱导的肝糖生成增加,以及胰高血糖素敏感性增强。而这种逆转归因于Alkbh5-HKO小鼠中GCGR-cAMP-PKA-CREB信号通路的激活以及糖异生相关基因的表达量上调。这些数据表明,ALKBH5对葡萄糖稳态的调节作用是通过GCGR来介导的。
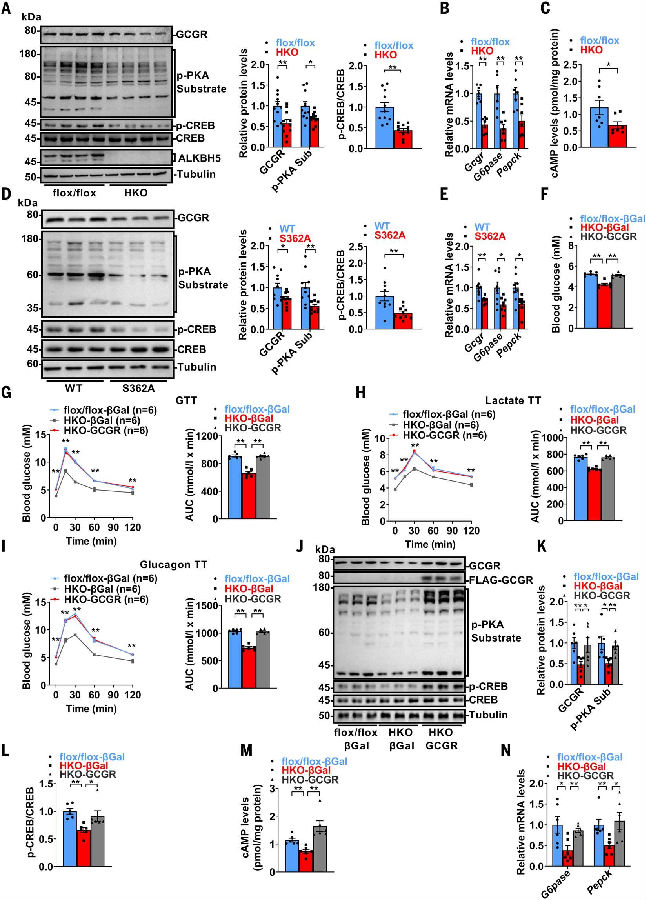
图3. ALKBH5通过GCGR调节葡萄糖稳态
(图片源自《Science》)
接下来,作者研究了ALKBH5影响GCGR调控的分子机制。通过m6A–RNA免疫沉淀测序(MeRIP-seq)和RNA测序(RNA-seq)分析,作者发现Alkbh5-HKO小鼠肝脏中Gcgr转录本的m6A修饰增加,同时Gcgr mRNA减少。这表明ALKBH5可能通过其去甲基化酶活性增强Gcgr的表达。作者随后构建了一个具有去甲基化酶失活突变(H205A)的ALKBH5突变体,并使用腺病毒进行功能检测,证实ALKBH5而非ALKBH5(H205A)能够恢复雄性Alkbh5-HKO小鼠肝脏中Gcgr、其下游信号通路以及糖异生相关基因(G6pase和Pepck)的减少。因此,ALKBH5而非ALKBH5(H205A)能够恢复葡萄糖稳态表型,包括血糖、葡萄糖耐量、乳酸诱导的葡萄糖生成以及胰高血糖素敏感性。作者又测量了Gcgr mRNA的稳定性。Alkbh5的缺失降低了原代肝细胞中Gcgr mRNA的稳定性,而野生型ALKBH5而非ALKBH5(H205A)增强了Gcgr mRNA的稳定性。这些证据强调了ALKBH5的去甲基化功能在调节Gcgr表达和稳定性方面的作用,从而影响葡萄糖代谢和胰高血糖素敏感性。
核糖核蛋白免疫沉淀(RIP)-RT-qPCR分析表明,ALKBH5直接与Gcgr转录本的m6A修饰区域相互作用。随后,作者研究了Gcgr转录本m6A区域内的GGACU基序对于ALKBH5调节作用的重要性。通过将该基序替换为GGCCU(命名为Gcgr-m6A Mut),发现ALKBH5以剂量依赖的方式增强了WT Gcgr-m6A构建体的荧光素酶活性,但对突变体构建体的活性没有影响。敲低Mettl3也能增加WT Gcgr-m6A构建体的荧光素酶活性。这些结果表明,ALKBH5通过调节Gcgr mRNA的m6A修饰和稳定性来调控葡萄糖稳态。
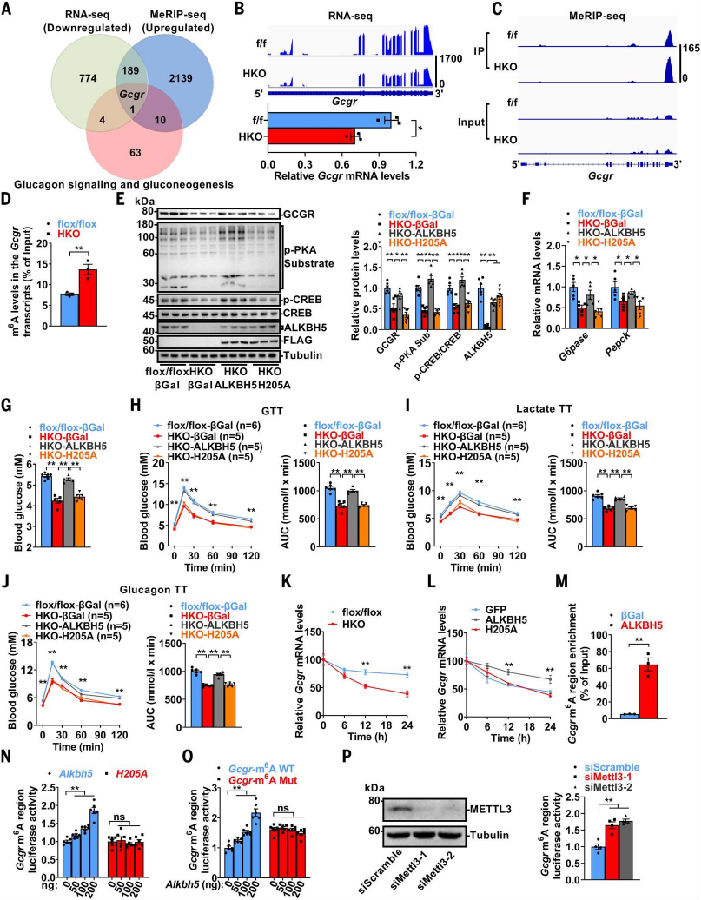
图4. ALKBH5通过其去甲基化活性促进Gcgr mRNA的稳定
(图片源自《Science》)
肝脏葡萄糖代谢与脂质代谢之间的相互关系促使作者对Alkbh5flox/flox和Alkbh5-HKO小鼠的脂质稳态进行了评估。在正常饮食条件下,两组小鼠的肝脏甘油三酯(TAG)水平相似。然而,在HFD条件下,雄性和雌性Alkbh5-HKO小鼠均表现出HFD诱导的MAFLD和高脂血症减轻。这种保护作用体现在肝脏TAG水平降低、S13A、脂滴减少、血清TAG和总胆固醇(TC)水平降低、血清丙氨酸氨基转移酶(ALT)活性降低以及慢性炎症因子(Tnfa,Ccl2,Il1a,Il1b,Il6,Ifng和Ccl5)表达降低。综上所述,这些发现表明,肝细胞特异性缺失Alkbh5不仅改善了葡萄糖稳态,还预防了HFD诱导的MAFLD和高脂血症。
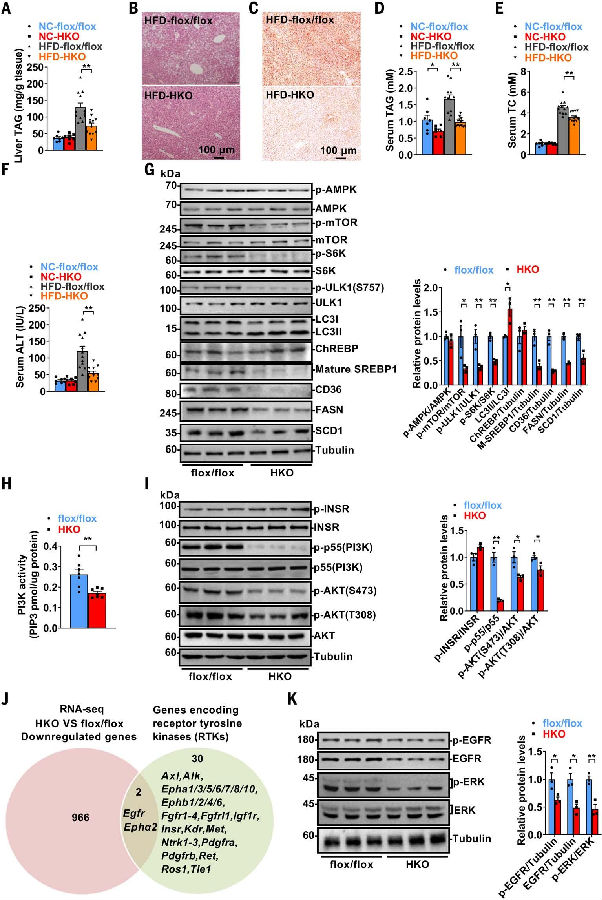
图5. 肝细胞特异性缺失Alkbh5可预防HFD诱导的脂肪变性及高脂血症
(图片源自《Science》)
为了探究ALKBH5在脂质稳态中的功能是否由EGFR介导,作者进行了EGFR挽救实验。通过Ad-EGFR腺病毒在从Alkbh5-HKO小鼠分离出的原代肝细胞中恢复EGFR表达,使p-EGFR、p-PI3Kp55、p-AKT、p-mTOR、p-ULK1、p-S6K、成熟的SREBP1、CD36、FASN和SCD1的水平得以恢复。同样,在雄性Alkbh5-HKO小鼠肝脏中恢复EGFR表达,抵消了这些信号分子的减少以及LC3II/LC3I比值的升高,从而导致了ALKBH5过表达还提高了EGFR水平,随后增加了EGFR-PI3K-AKT-mTORC1信号通路成分的磷酸化以及成熟的SREBP1、CD36、FASN和SCD1的量。EGFR抑制剂拉帕替尼能有效地阻断ALKBH5诱导的这些信号通路的激活。这些结果表明,ALKBH5通过EGFR-PI3K-AKT-mTORC1信号通路影响MAFLD。
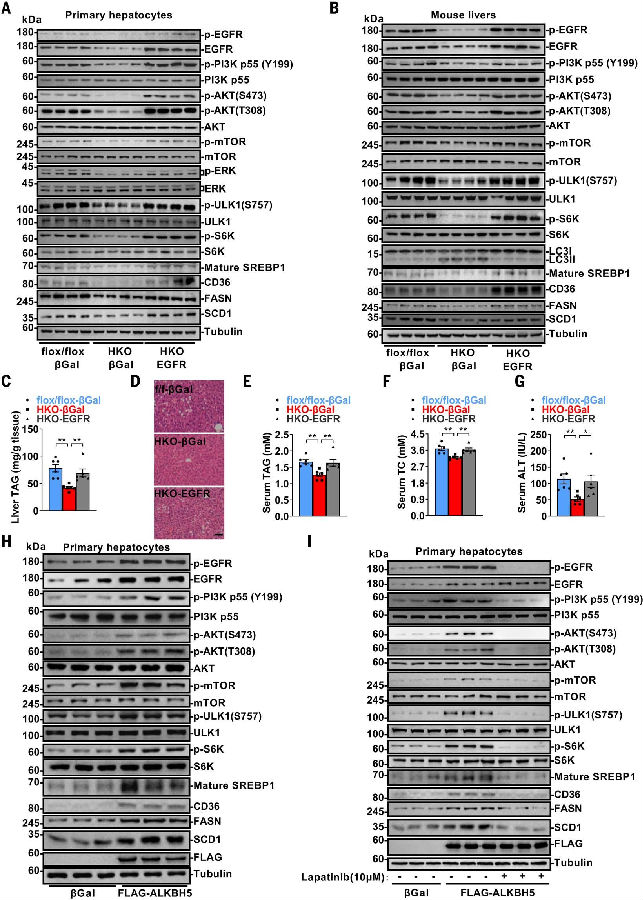
图6. ALKBH5通过EGFR-PI3K-AKTmTORC1信号通路调节MAFLD
(图片源自《Science》)
作者发现,肝细胞特异性敲除Alkbh5可改善葡萄糖和脂质稳态,这表明ALKBH5是治疗代谢性疾病的一个很有前景的靶点。为了进一步验证抑制肝脏ALKBH5的治疗效果,作者使用N-乙酰氨基半乳糖(GalNAc)偶联的修饰型siRNA来沉默db/db小鼠肝脏中的Alkbh5基因。GalNAc-siAlkbh5能够有效且特异性地降低db/db小鼠肝脏中ALKBH5的水平。尽管这两组小鼠的体重相似,但通过GalNAc-siAlkbh5敲低db/db小鼠肝脏中的Alkbh5基因,其空腹血糖水平降低,血清胰岛素水平降低,葡萄糖耐量得到改善,肝脏葡萄糖生成减少,胰高血糖素敏感性降低,这可能是由于GCGR-cAMP-PKA-CREB信号通路的下调以及与糖异生相关的基因表达降低。此外,通过GalNAc-siAlkbh5敲低db/db小鼠肝脏中的Alkbh5基因,还改善了MAFLD。这些研究结果共同表明,在db/db小鼠中通过RNAi技术介导的肝脏Alkbh5敲低,能够有效逆转T2DM和MAFLD,其机制在于抑制了GCGR-cAMP-CREB和EGFR-PI3K-mTORC1信号通路。
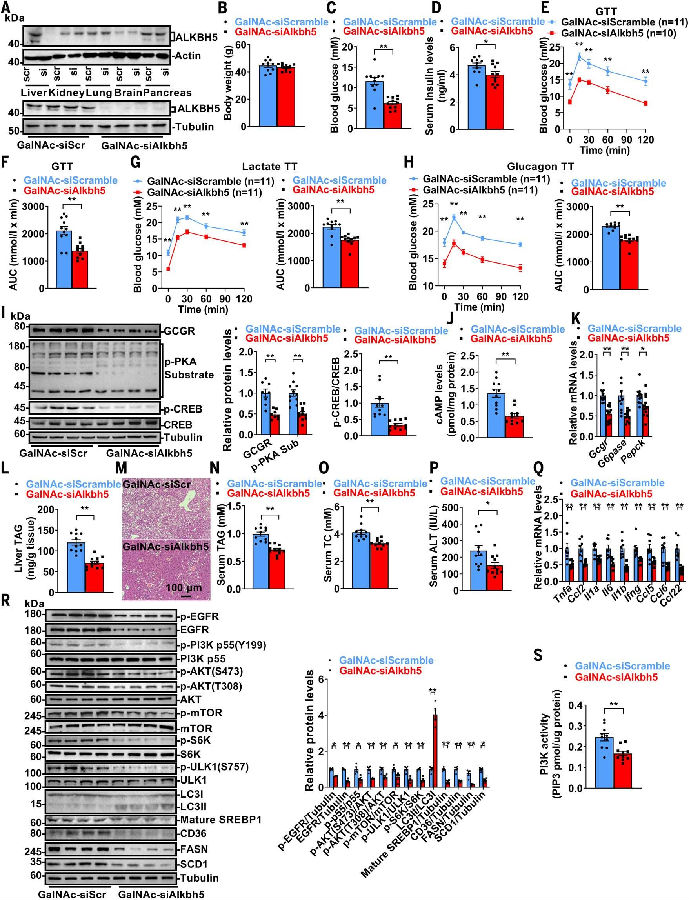
图7. 肝脏特异性敲低Alkbh5可逆转db/db小鼠的T2DM、MAFLD和高脂血症。
(图片源自《Science》)
本研究结果表明,ALKBH5通过影响GCGR和mTORC1通路,为T2DM和MAFLD提供了一个潜在的治疗靶点。另外,RBPs可以被策略性地操控用于治疗目的,以对抗代谢疾病。
云克隆开发了上述研究中相关指标产品以助力科学研究,部分指标如下,供您参考:
![S(HT$T2(3D8M0E5%8]PU8EO.png](http://static.cloud-clone.cn/topic/cn/67fcfe467e615.png)