IL-33激活ILC2s诱导胰腺癌三级淋巴结构的形成
胰腺导管腺癌(PDAC)作为“免疫冷肿瘤”,肿瘤微环境中免疫细胞浸润较少,对免疫检查点抑制剂等免疫疗法的响应性极差。PDAC中会形成很少的三级淋巴结构(TLSs),当存在TLSs时,生存率较高,但TLSs在PDAC中形成的机制及其调控因子尚未明确。TLSs是慢性炎症组织中形成的异位淋巴聚集物,能调节慢性炎症组织(包括肿瘤)中的免疫反应,它通过炎症触发LT-LTβR(淋巴毒素-LTβ受体)通路的激活而形成,但目前未完全明确诱导TLSs的炎症信号和细胞。
2025年1月15日,有研究团队在《Nature》期刊上发表了题为“IL-33-activated ILC2s induce tertiary lymphoid structures in pancreatic cancer”的文章,该文章表明在PDAC的TLSs中检测到潜在的淋巴源性ILC2s(2型天然淋巴细胞)和IL-33表达细胞。炎症组织释放的IL-33通过激活ILC2s诱导TLSs的形成,从而增强了抗肿瘤免疫反应。设计表达的重组人IL-33蛋白可以增加肿瘤内淋巴源性ILC2s和TLSs,在PDAC小鼠中显示出增强的抗肿瘤活性。

该文章研究思路如下:
一、IL-33介导淋巴细胞生成
为了确定肿瘤中诱导TLSs的候选炎症信号,研究者分析了人PDAC中与已知TLSs转录特征正相关的表达基因。发现肿瘤中IL-33+细胞比临近胰腺组织丰富,而有TLSs的肿瘤中IL-33+细胞更丰富。后发现激活LTβR在野生型小鼠(WT)中产生瘤内TLSs,但在Il33-/-PDAC小鼠中不能产生TLSs。利用化学性结肠炎小鼠模型模拟人类炎症性肠病发现炎症诱导的淋巴细胞生成也需要Il33。用重组IL-33蛋白(rIL-33)处理PDAC小鼠和化学性结肠炎小鼠,结果显示IL-33的警示结构域(IL-33 109-266)触发了癌症和炎症中的淋巴生成。该结构域可与ST2(suppression of tumorigenicity 2)结合,ST2是一种白介素受体蛋白,也被称为IL1RL1、T1或 IL33R。(见图1)
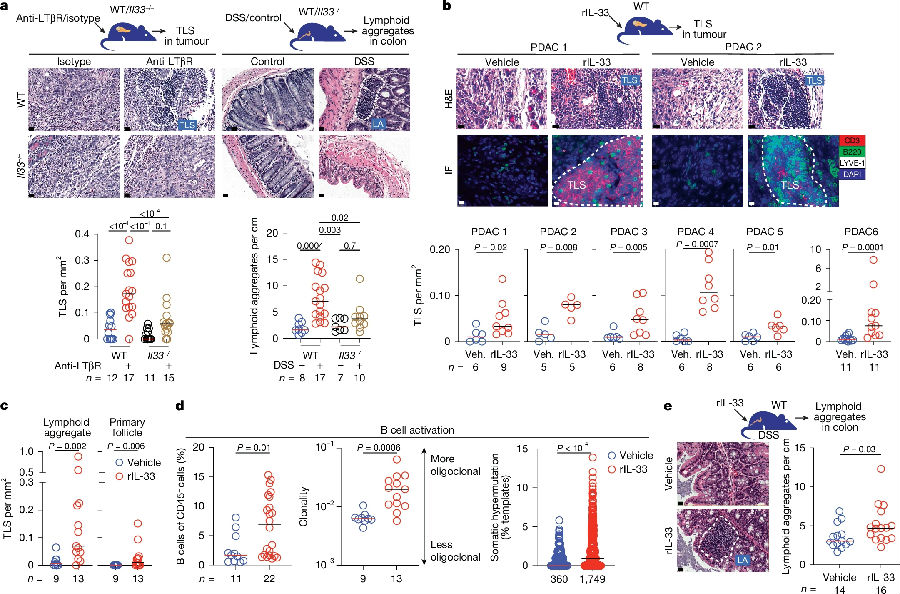
图1. IL-33的警示结构域诱导PDAC和化学性结肠炎的TLSs
(图片来源于《Nature》杂志)
二、验证IL-33对ILC2s的激活作用。
研究者希望进一步鉴定介导IL-33诱导TLSs生成的细胞。他们之前验证过rIL-33在PDAC小鼠中主要增加了肿瘤内ST2+ILC2s,故在rIL-33处理的PDAC小鼠的肿瘤和肿瘤引流淋巴结(DLNs)中检测了ST2+ILC2s的单细胞转录组,检测到肿瘤内ILC2s共表达Klrg1和Ltb、Lta和LT,而LTα1/β2异源三聚体细胞因子是TLSs新生成所必需的。在PDAC模型和化学性结肠炎小鼠中,rIL-33使肿瘤内表达LT的KLRG1+ILC2s增多。这些肿瘤内KLRG1+ILC2s也表达典型的ILC2转录因子(Gata3、Rora和Id2)、细胞因子(Il5、Il13和Areg)和受体(Il7r和Nmur1),而不表达ILC1或ILC3转录因子。为了验证ILC2s是否利用细胞内LT诱导肿瘤内TLSs,培育了ILC2s上缺乏Ltb的转基因小鼠,发现转基因小鼠中肿瘤内TLSs减少。由此得出ILC2s有助于IL-33介导的淋巴细胞生成,rIL-33激活的KLRG1+ILC2s通过涉及LT的途径诱导PDAC中的TLSs。(见图2)
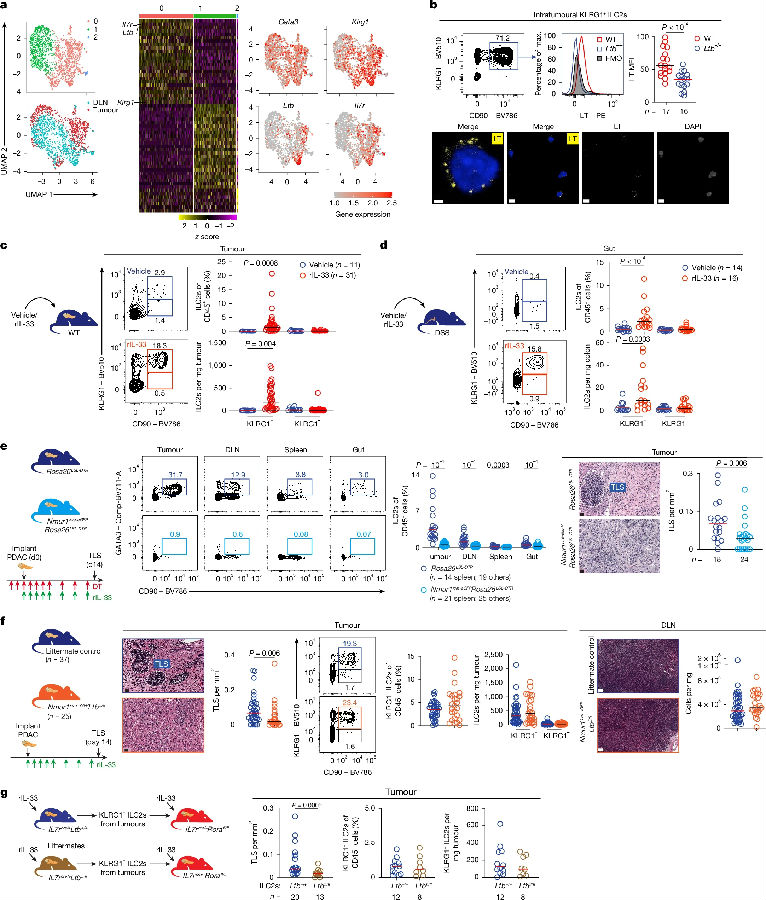
图2. IL-33激活淋巴源性ILC2s
(图片来源于《Nature》杂志)
三、淋巴源性ILC2s可以从肠道迁移
由于ILC2s具有淋巴生成功能,可以从肠道迁移到组织中。研究者假设肠道是KLRG1+ILC2s迁移到胰腺肿瘤的一个来源。用rIL-33处理转基因小鼠,发现KLRG1+ILC2s可以通过肠-血回路迁移到PDAC。为了研究PDAC是否启动了这种肠源性迁移的ILC2回路,研究者寻找了可能刺激ILC2s迁移的肠源性信号。发现PDAC增加了胰腺内KLRG1+ILC2的比例、肠道Il33 mRNA的表达、肠道微生物群的多样性并改变了其组成。结果表明KLRG1+ILC2s可以从肠道迁移到肿瘤,并受到肠道微生物群的调节。(见图3)
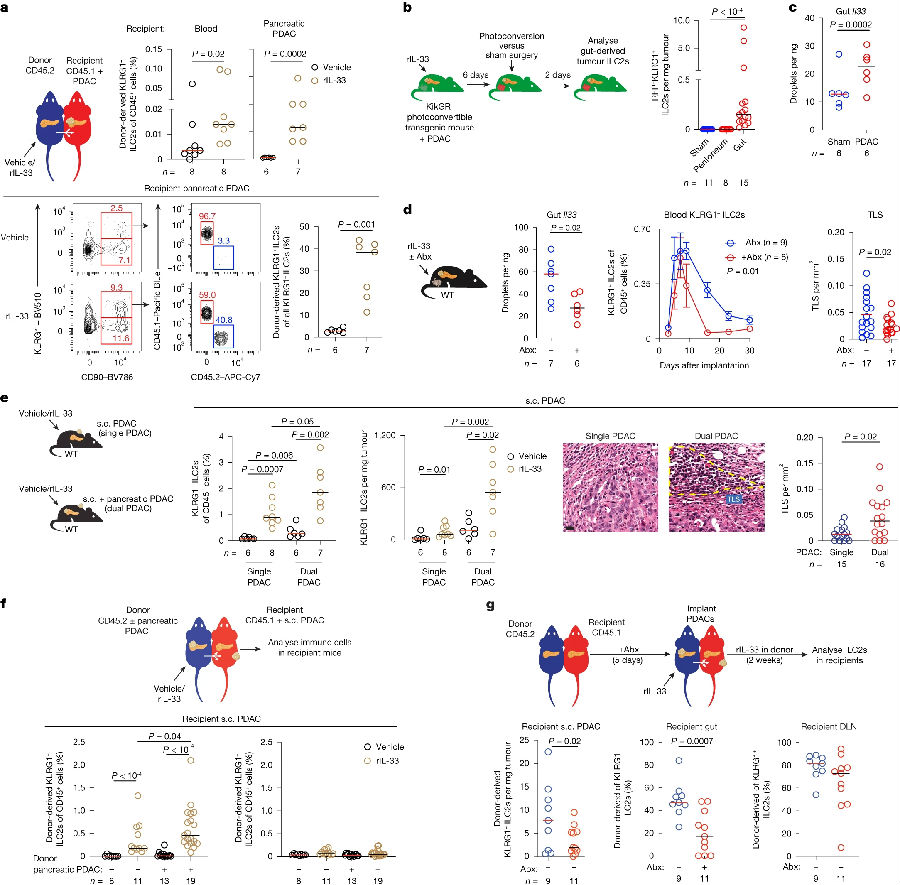
图3. 淋巴源性ILC2s可以从肠道迁移到肿瘤
(图片来源于《Nature》杂志)
四、工程化的IL-33可增加淋巴细胞生成
研究者想进一步验证他们的发现跟人疾病的相关性,结果发现在人PDAC组织样本中,检测到表达LT的KLRG1+ILC2s。研究者设计了人IL-33重组蛋白(H-rIL-33),后将人IL-33 112-270中含有的4个半胱氨酸残基全部替换为丝氨酸残基以消除引发二硫键和构象改变的半胱氨酸氧化,防止破坏IL-33的ST2结合位点,得到H-e-rIL-33。发现与H-rIL33相比,H-e-rIL-33增强了ST2的激活。再将H-e-rIL-33融合到人类IgG1 Fc片段以延长H-e-rIL-33在体内的半衰期,发现最终改造的重组蛋白增强了体外ST2激活。由于人IL-33在小鼠中具有生物活性,研究者将最终改造的人IL-33重组蛋白用于小鼠中,发现重组蛋白以剂量依赖的方式增加瘤内KLRG1+ILC2s和TLSs,从而控制PDAC肿瘤。(见图4)
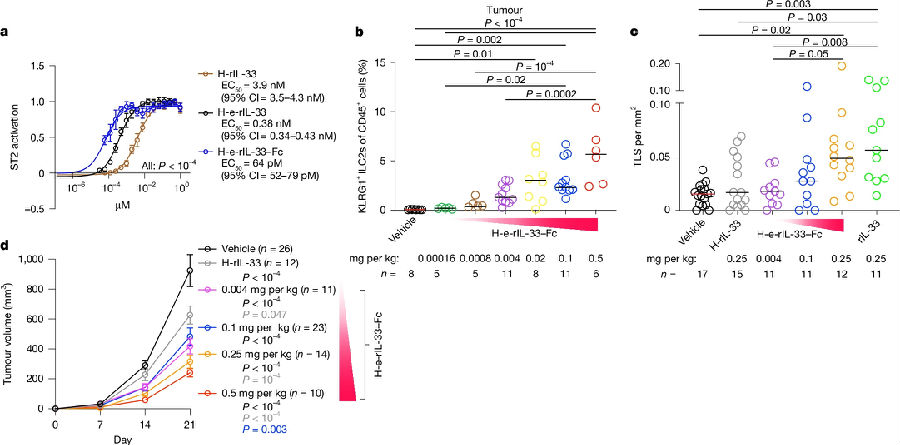
图4. 一种工程化的人IL-33治疗药物刺激PDAC的TLSs和抗肿瘤活性
(图片来源于《Nature》杂志)
基于该研究结果,IL-33表达水平可作为PDAC患者免疫治疗反应的预测指标,开发IL-33激动剂可能可以增强TLSs的形成并提高免疫检查点抑制剂的疗效,为“冷肿瘤”免疫激活提供了新靶点。
云克隆开发了与该研究相关的靶标产品,部分指标节选如下:
更多信息,欢迎访问:http://www.cloud-clone.cn/