抑制EZH1/EZH2增强CAR-T等免疫疗法进击多种肿瘤模型
肿瘤对嵌合抗原受体T细胞(CAR-T)等过继细胞免疫疗法(ACTs)的耐药性是临床上的一个主要挑战,尽管ACTs在肿瘤治疗中取得了巨大成功,但大部分的病人在治疗中仍然会失败,主要原因就是ACTs的耐药性,如有限的T细胞浸润、肿瘤细胞逃避T细胞识别和凋亡的能力、T细胞功能障碍。EZH2是一种组蛋白甲基转移酶,介导H3K27me3并驱动转录沉默,且在多种液体和实体瘤大量表达,EZH1是EZH2的功能同源物。在这项研究中,评估了EZH2和EZH1/ EZH2双重抑制对血液和实体肿瘤模型中CAR-T和TCR-T细胞治疗的影响,相关研究成果发表于《Cancer Cell》。
1. EZH2抑制使淋巴瘤细胞对CART19治疗敏感
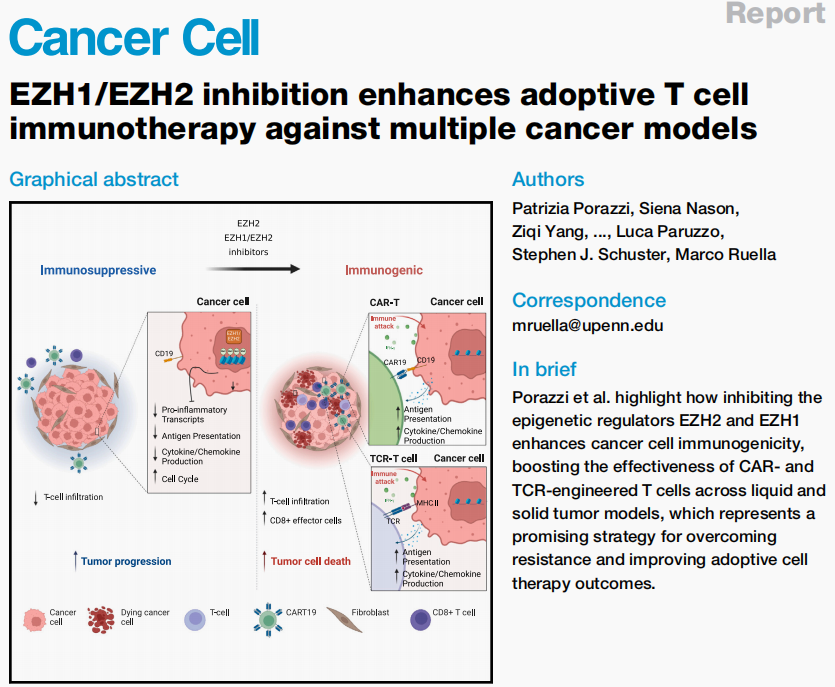
首先探索tazemetostat(Taz)抑制EZH2增强CART19(抗CD19嵌合抗原受体T细胞)免疫治疗的潜力,因为这种治疗方法批准用于依赖EZH2的GC B型淋巴瘤,所以研究团队选择了四种弥漫性大B细胞淋巴瘤(DLBCL)细胞系(野生型EZH2:OCI-Ly18和Toledo,突变型EZH2:SU-DHL-4和Karpas-422)。实验中使用次优剂量的Taz敲除H3K27三甲基化且不影响短期内细胞的存活和增殖,以此来评估Taz联合CART19(CART19-Taz)的治疗潜力,随后,在体外和体内实验中证实CART19-Taz可以显著提高CAR-T细胞的抗肿瘤疗效。
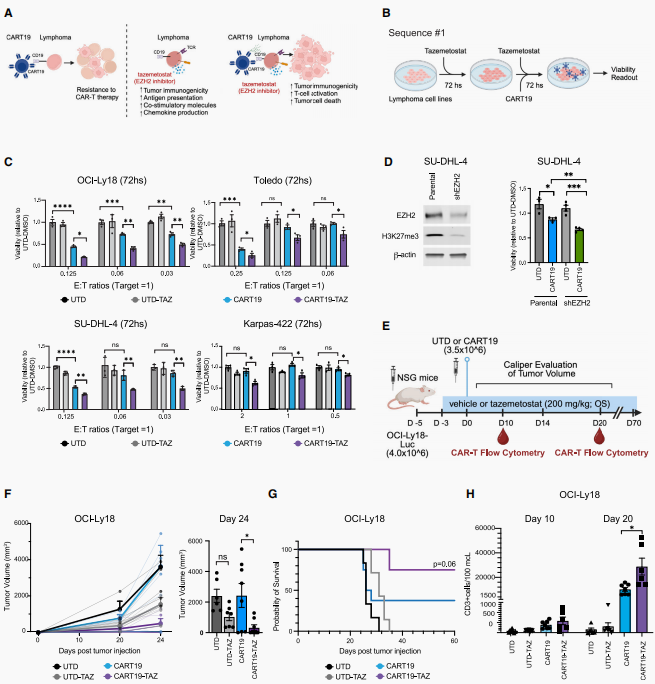
图1. Taz联合CART19显著提高CAR-T细胞的抗肿瘤疗效
图片源于《Cancer Cell》
2. EZH2抑制重塑肿瘤的免疫原性
那么,EZH2抑制是如何增强CAR-T治疗效果的呢?发现暴露于CART19-Taz的肿瘤细胞特异性上调了相关基因,包括:炎症(IL2RA)、B细胞活化/分化(如KDM5B、BACH2)、粘附(如TNFSF4、CD80)、T细胞趋化因子(如CXCL9、CXCL10、CXCL16)和细胞运动(如LMNA、CEACAM1、NRCAM、EPHB2)。进一步探索EZH2抑制在体内实验中对CART19免疫疗法的影响,发现CART19治疗组肿瘤体积明显变小,并将肿瘤组织用于病理和基因表达分析。病理结果显示CART19-Taz组肿瘤组织中观察到更小、更多的坏死肿瘤且T细胞浸润显著增加。差异表达基因热图结果显示,EZH2抑制可显著上调MHC-I/II抗原(HLA-A、HLA-DOA、HLA-DOB)、共刺激分子(CXCL9、CXCL10、CD40)、黏附分子(ICAM1)、B细胞活化标志(FOS、JUN)、干扰素(IFN)应答通路(STAT1-3、IRF2/7/9)和p53介导的凋亡相关基因(FAS、ATF3、CASP3/4/7、MCL1、MDM2)。以上结果表明,EZH2抑制重塑肿瘤的免疫原性,调节炎症和凋亡途径。随后评估CART19细胞与肿瘤细胞的亲和力,发现Taz预处理显著增强了CART19细胞对肿瘤细胞的亲和力,表明肿瘤细胞与CAR-T细胞的结合效率增强,EZH2抑制增强了肿瘤与CAR-T细胞的相互作用。
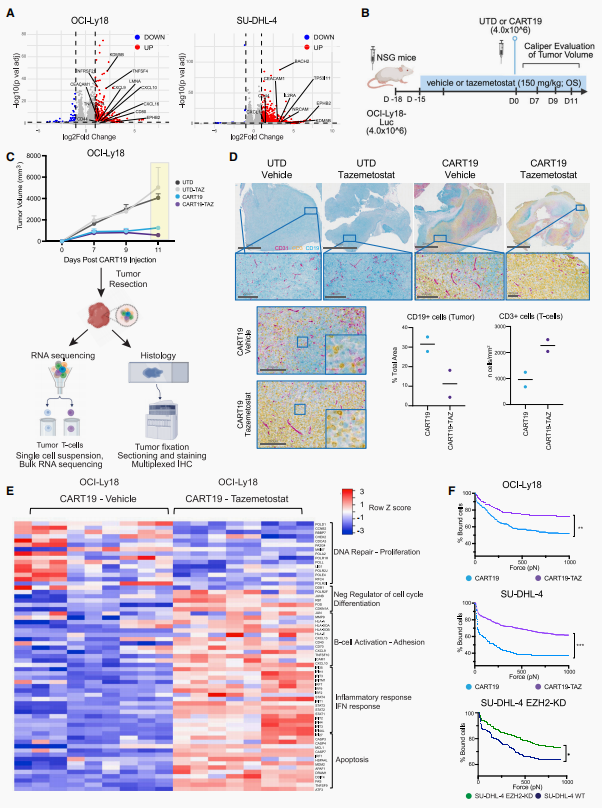
图2. EZH2抑制增强肿瘤的免疫原性
图片源于《Cancer Cell》
3. EZH2抑制增强CART19细胞的细胞毒性
研究团队进一步探究了EZH2抑制对CAR-T细胞的影响。体外实验显示,与经Taz预处理的肿瘤细胞共培养时,该药物能显著增强CAR-T细胞的细胞因子分泌(IFN-γ、TNF和IL-2),提升长期杀伤能力,并促进细胞扩增。流式细胞术进一步证实经Taz处理的CART19细胞中效应记忆T细胞亚群比例增加。为评估CAR-T细胞的持续功能,进行了再攻击实验:将CART19细胞与经Taz预处理或未处理的SU-DHL-4细胞共培养,并分别在4天、7天和11天时重新引入未处理的肿瘤细胞以诱导CAR-T细胞功能衰竭,结果发现,与Taz联用的CART19细胞相较于单独的CART19细胞,能持续保持更强的细胞毒性和扩增能力,且后者呈现杀伤效能下降和增殖减弱的现象。进一步研究体内肿瘤浸润性CART19细胞的特性,Taz处理组肿瘤中的CART19细胞进行基因集富集分析(GSEA)显示,相较于对照组,这些细胞的激活与细胞毒性相关基因(如GZMB、PRF1、IFNG和CD69)表达上调,而耗竭标志物(如LAIR2)表达下调。这些发现表明,EZH2抑制增强了T细胞的浸润,并促进了肿瘤内CART19细胞的肿瘤反应性和细胞毒性。为了进一步研究EZH2抑制对血液中CART19细胞的影响,发现CART19-Taz治疗能改善肿瘤控制并延长生存期。此外,当SU-DHL-4细胞预先Taz处理,再暴露于野生型或EZH2敲除的CART19细胞时,Taz仍能增强两组细胞的细胞毒活性。这些研究结果表明,Taz通过抑制EZH2重塑肿瘤细胞的免疫原性,从而促进CART19细胞更有效的活化,并保持CAR-T细胞的抗肿瘤效应。
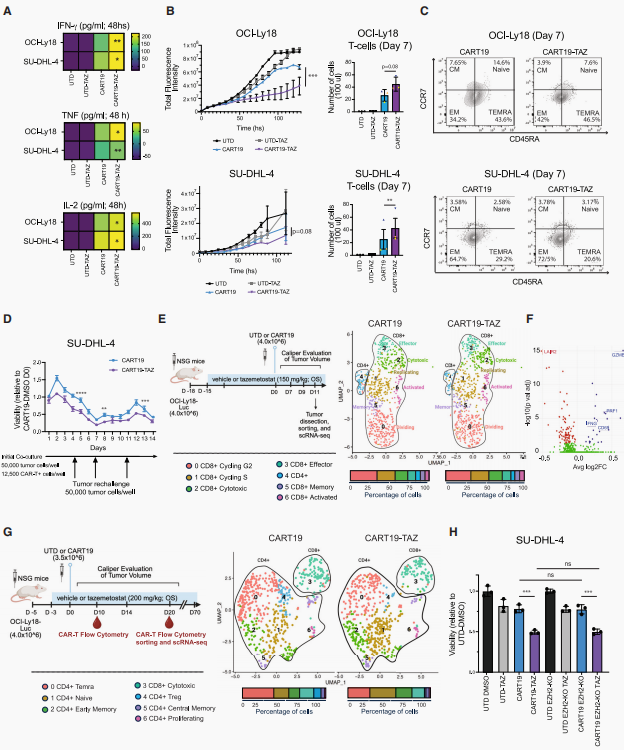
图3. EZH2抑制增强CART19细胞的细胞毒性
图片源于《Cancer Cell》
4. EZH2及EZH1/EZH2双重抑制显著增强基于CAR-T和TCR-T细胞的免疫疗法对多种血液肿瘤和实体瘤的抗肿瘤疗效
接下来,研究团队试图研究CAR-T免疫治疗在液体和实体癌症中的作用。首先针对B细胞淋巴瘤开发了靶向CD22和CD79b的CAR-T细胞疗法——鉴于B细胞恶性肿瘤治疗中迫切需要解决耐药性和抗原逃逸问题的替代靶点,值得注意的是,EZH2抑制在这些模型中显著增强了CAR-T细胞的杀伤效果。在血液系统恶性肿瘤中,证实EZH2抑制具有广泛增强CAR-T疗法对血液恶性肿瘤疗效的潜力。进一步研究EZH2抑制在实体瘤(如HER2+卵巢癌、前列腺癌及肉瘤)中的联合治疗效果,观察到Taz联合CAR-T细胞的长期杀伤作用显著增强,并将此扩展到上皮样肉瘤,发现Taz显著提高TCR-T细胞对癌细胞的杀伤作用。以上数据表明,EZH2抑制剂对多种实体瘤及各类过继性T细胞免疫疗法均具有广阔的应用前景。随后提出假设:由于EZH2被抑制时EZH1的代偿作用及其在非增殖细胞中的表达特性,联合抑制EZH1与EZH2可能会进一步增强CAR-T疗效。发现EZH1/EZH2双重抑制剂(valemetostat,VAL)确实可以显著提升CART19的肿瘤杀伤效力,随后通过再攻击实验发现VAL处理的CART19细胞表现出更强更持久杀伤能力。进一步在RPMI-8226骨内原位移植瘤模型中证实VAL可增强靶向BCMA(B细胞成熟抗原)的CAR-T细胞的肿瘤控制效果,促进外周血T细胞扩增,且其血清中细胞毒性细胞因子IFN-γ水平升高,表明T细胞的活化程度及细胞毒性反应增强。
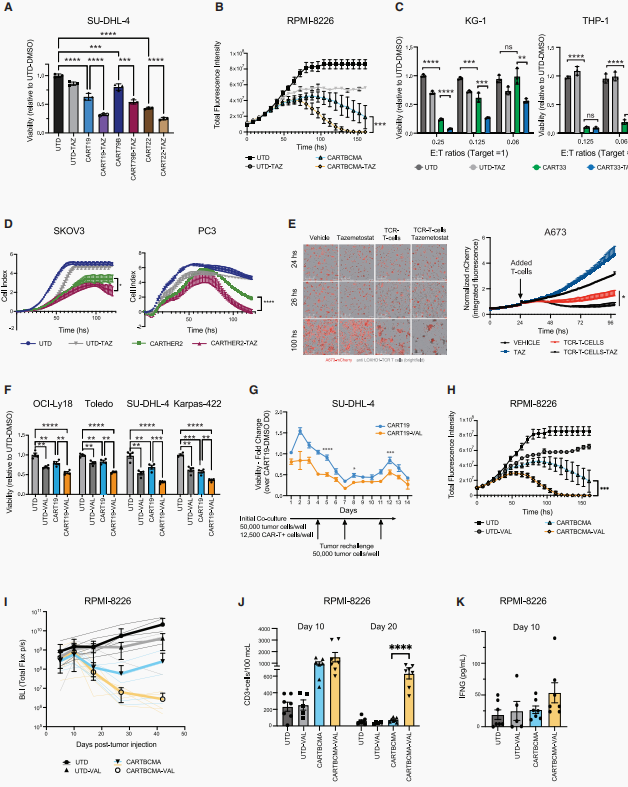
图4. EZH2以及EZH1/EZH2抑制增强血液肿瘤和实体瘤模型的免疫治疗效果
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、试剂盒等产品以助力相关研究,部分指标节选如下,供参考:
指标名 | 核心货号 | 指标名 | 指标名 |
EZH1 | K072 | EZH2 | K073 |
CD19 | B873 | CD3e | D117 |
CD3g | D118 | IL2RA | B837 |
TNFSF4 | A850 | CD80 | B386 |
CXCL9 | B928 | CXCL10 | A371 |
CXCL16 | A771 | LMNA | F550 |
CEACAM1 | C977 | NRCAM | C668 |
EPHB2 | E117 | CD44 | A670 |
CD40 | B249 | ICAM1 | A548 |
FOS | B291 | JUN | B292 |
IFNg | A049 | STAT1 | B740 |
STAT2 | B796 | STAT3 | B743 |
IRF2 | C180 | IRF9 | H780 |
FAS | A030 | ATF3 | C303 |
CASP3 | A626 | CASP4 | B735 |
CASP7 | A449 | MCL1 | C615 |
MDM2 | G790 | LAMC1 | C082 |
LAMA1 | A574 | FOXO3 | A762 |
IL10 | A056 | CDK6 | C059 |
CD58 | A903 | IL2 | A073 |
TNFa | A133 | GZMB | A600 |
PCNA | A591 | CD8a | B099 |
CD4 | B167 | TGFb1 | A124 |
Smad3 | C123 | CD33 | A020 |