ALDH7A1抗铁死亡新机制:膜NADH生成与FSP1调控
铁死亡是一种由铁诱导的脂质过氧化介导的细胞死亡形式。铁死亡抑制蛋白1(FSP1)通过生成抗氧化剂来抵御这种死亡,这一过程需要还原型烟酰胺腺嘌呤二核苷酸(NADH)作为辅因子。NADH通过在酶反应中充当辅因子参与各种细胞事件。目前已知的NADH作用涉及其可溶性形式,但NADH是否以显著水平存在于细胞膜上以及膜NADH可能起什么作用尚未得到研究。
2025年4月14日,美国哈佛医学院的研究团队在《Cell》上发表了题为“ALDH7A1 protects against ferroptosis by generating membrane NADH and regulating FSP1”的研究论文,这项研究通过揭示细胞膜上以前未被发现的NADH“池”,加深了对NADH的基本理解,为理解FSP1的作用机制以及醛脱氢酶如何抵御铁死亡提供了重要见解。

1. 细胞膜含有大量的NADH且膜NADH需要ALDH7A1活性
由于尚不清楚NADH在细胞膜上的存在水平,研究团队检测了各种细胞,发现膜NADH是一种普遍现象。醛脱氢酶(ALDHs)家族将底物中的醛基转化为产物中相应的羧基,涉及将烟酰胺腺嘌呤二核苷酸(NAD)转化为NADH。醛脱氢酶7A1(ALDH7A1)是该家族中高度保守的成员。研究团队用针对ALDH7A1的小干扰RNA(siRNA)处理细胞,发现膜NADH优先降低,膜NADH水平较高的细胞受到的影响更大。膜NADH需要ALDH7A1的催化活性来支持,因为通过表达野生型ALDH7A1而不是催化失活形式(E268Q),可以恢复针对ALDH7A1的siRNA降低的水平。此外,针对多种其他ALDH成员的siRNA并没有降低膜NADH水平。因此,ALDH7A1在支持膜NADH水平方面显示出特异性(图1)。之前已经发现ALDH7A1在S102残基上的磷酸化可以促进其膜定位。用S102A(阻止磷酸化)或S102D(模拟磷酸化)形式替换内源性ALDH7A1,发现S102A表达降低了膜上的NADH水平,而S102D表达增加了膜上NADH水平。因此,ALDH7A1需要被招募到细胞膜上以支持膜NADH水平。
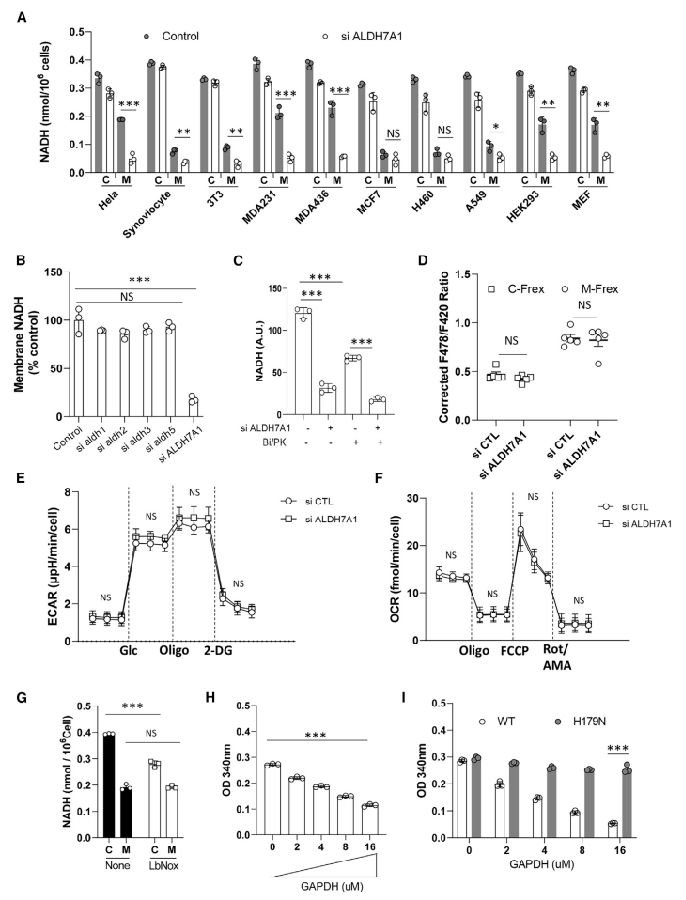
图1 ALDH7A1活性是膜NADH水平的主要决定因素
(图片源于《Cell》)
2. ALDH7A1支持FSP1活性
研究团队进一步确定膜NADH的功能。在文献检索中,注意到FSP1已被发现可以预防铁死亡,其作用涉及将泛醌还原为泛醌醇,这需要NADH作为辅因子。此外,FSP1仅在膜上具有活性。因此,团队探索了ALDH7A1产生的膜NADH支持FSP1活性的可能性。他们发现,使用siRNA干扰ALDH7A1或FSP1与使用RSL3(GPX4抑制剂)诱导铁死亡导致相似程度的细胞死亡和脂质过氧化。他们证实了观察到的细胞死亡是由铁死亡引起的,因为它可以通过铁死亡抑制剂来预防。接下来,他们探讨了ALDH7A1对铁死亡的保护作用是否与细胞表现出不同水平的膜NADH有关。酰基辅酶A(CoA)合成酶4(ACSL4)是合成多不饱和脂肪酸的关键酶。通过转染MCF7细胞过表达ACSL4,发现ACSL4导致MCF7细胞对RSL3处理诱导的铁死亡的敏感性增加。ACSL4过表达也导致RSL3处理更显著地增加了膜NADH水平,这种增加依赖于ALDH7A1。此外,抗ACSL4的siRNA导致细胞死亡和脂质过氧化减少,并降低膜NADH水平。因此,这些结果提示细胞膜NADH水平与细胞对铁死亡的易感性程度相关。接下来,研究团队寻找更多的直接证据,证明ALDH7A1是FSP1活性所必需的(图2)。通过共沉淀实验,他们发现ALDH7A1在MDA231细胞和其他多种细胞类型中与FSP1相互作用。使用CRISPR-Cas9敲除了ALDH7A1,发现生成的细胞在正常条件下甚至不能存活,而是需要用铁抑制素1处理或重新表达ALDH7A1才能存活。
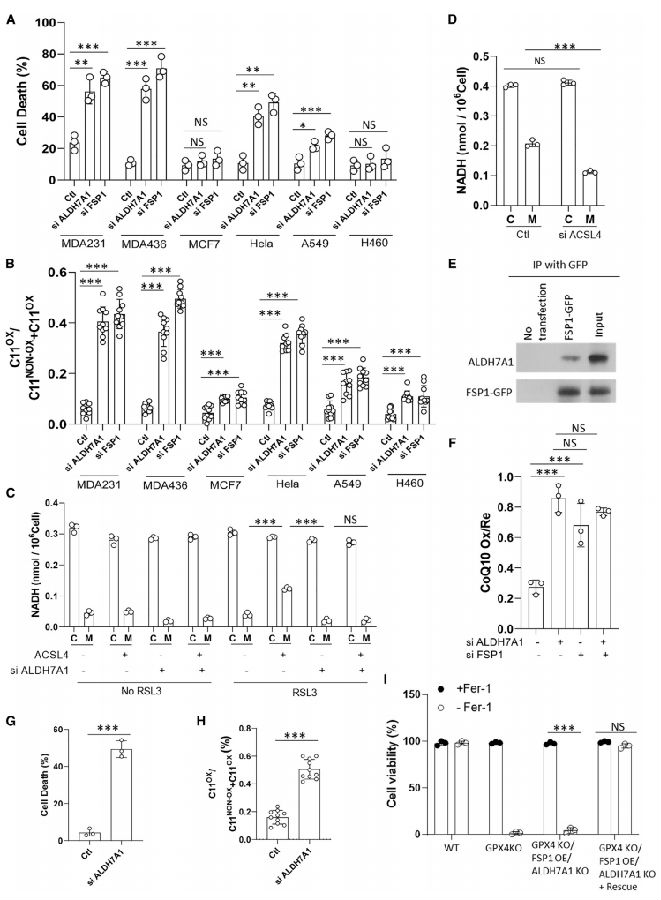
图2 ALDH7A1通过FSP1抵抗铁死亡
(图片源于《Cell》)
3. ALDH7A1将FSP1招募到细胞膜上通过级联信号调控FSP1活性
FSP1的募集需要ALDH7A1的存在,这需要ALDH7A1的膜结合(S102D)而不是可溶性(S102A)形式。RSL3处理增加的铁死亡应激诱导MDA231细胞中内源性FSP1的膜募集,这种募集被抗ALDH7A1的siRNA阻止。研究团队进一步证实ALDH7A1的膜募集作用不需要其催化活性,因为催化失活的ALDH7A1的表达仍然支持RSL3处理将FSP1募集到膜上的能力。该突变体ALDH7A1的表达导致细胞膜NADH水平显著降低。研究团队试图阐明铁死亡应激如何通过ALDH7A1诱导FSP1的膜募集。用AMPK抑制剂处理细胞,可以阻止RSL3处理促进的FSP1膜募集。当细胞用抗AMPK的siRNA处理时,得到了类似的结果。相反,用AMPK激活剂处理,可导致FSP1被募集到膜上,而无需RSL3处理。为了进一步支持ALDH7A1介导AMPK调节FSP1募集的能力,团队发现当内源性ALDH7A1被S102A形式所取代时,AMPK的激活不再能够诱导FSP1募集。相反,当内源性ALDH7A1被S102D形式取代时,针对AMPK的siRNA不再能够将膜FSP1重新分配到胞质中。因此,这些发现揭示了一个信号级联,通过ALDH7A1调节FSP1的膜募集。在铁死亡应激诱导下,细胞ATP水平降低,激活AMPK磷酸化ALDH7A1,导致ALDH7A1定位于膜上,从而稳定募集FSP1(图3)。
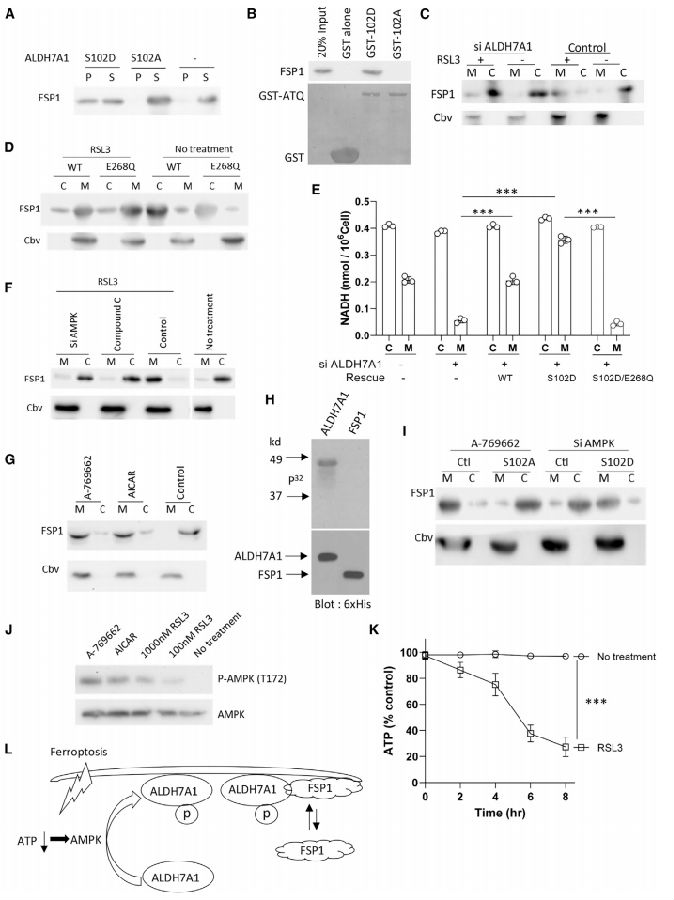
图3 信号级联调节FSP1向膜的募集
(图片源于《Cell》)
4. 对铁死亡的易感性调节信号机制的激活
研究团队注意到,FSP1的表达水平在很大程度上与细胞依赖FSP1预防铁死亡的程度相关。然而,一些细胞,如H460,仅在诱导高水平铁死亡应激时才表现出FSP1依赖性。因此,研究团队探讨阐明的信号机制是否可以为解释提供线索。通常剂量的RSL3处理诱导的铁死亡应激不能促进H460细胞中ALDH7A1或FSP1的膜募集。进一步分析发现,常规剂量的RSL3处理不能激活AMPK,而是需要高剂量的RSL3处理,这反映在AMPK的T172残基磷酸化上。也需要更高剂量的RSL3处理来降低细胞ATP水平。这些结果表明,在H460细胞中,铁死亡应激损害了降低细胞ATP水平的能力。为了进一步表征这一缺陷,研究团队探讨了在H460细胞中过表达ACSL4是否也会增加对铁死亡应激的易感性。ACSL4过表达本身并不激活信号级联。ACSL4过表达导致H460细胞更容易受到铁死亡应激,这反映在标准剂量RSL3处理时细胞死亡增强。这种处理还降低了细胞ATP水平,并诱导FSP1向细胞膜募集。通过细胞死亡和脂质过氧化评估,H460细胞的这种转化导致它们更依赖于ALDH7A1和FSP1来抵抗铁死亡。此外,这种依赖性的增加与更高水平的膜NADH相关。因此,这些结果为H460细胞如何依赖于FSP1来抵抗铁死亡提供了一个微妙的解释。由于ACSL4在正常情况下表达水平相对较低,因此它们对铁死亡具有相对的抗性。然而,当面临高水平的铁死亡应激时,它们对FSP1的保护依赖变得明显。
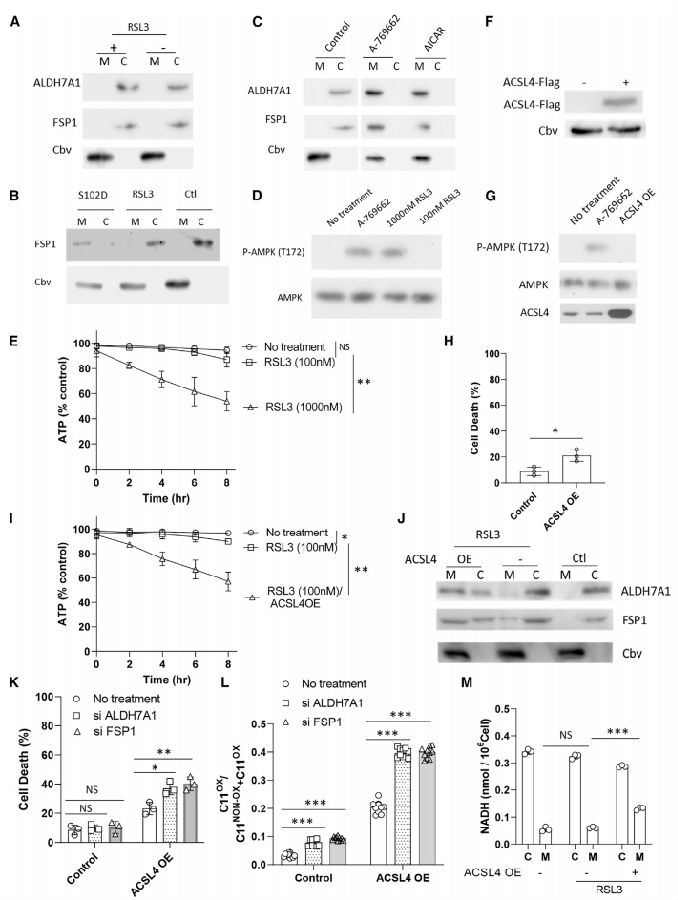
图4 激活H460细胞中的信号级联需要较高的铁死亡应激
(图片源于《Cell》)
综上所述,这项研究发现了ALDH7A1预防铁死亡的新方式,即促进膜NADH生成和调节FSP1向膜的募集。这一发现揭示了一种调节FSP1活性的信号机制,为理解FSP1的作用机制引入了一个新的方向。
云克隆公司助力科学研究,为广大科研人员提供相关检测试剂产品,相关靶标核心货号如下:
靶标 | 核心货号 | 靶标 | 核心货号 |
ACSL4 | D674 | GSH | A294 |
ALDH7A1 | E837 | LAMP1 | B441 |
AMPK | A679 | LPCAT3 | G531 |
CNX | A280 | LPO | A296 |
VAMP3 | F563 | MDA | A597 |
COX4 | D286 | NAD | G409 |
FTH | D021 | SLC7A11 | E410 |
GPX4 | C994 | TFR | B171 |
更多科研试剂,欢迎访问云克隆官方网站:http://www.cloud-clone.cn/