Nature揭秘溶酶体铁的激活触发癌细胞铁死亡
铁可催化生物膜中脂质的氧化反应,进而诱发铁死亡。明确这一化学反应在细胞内的发生位点,将有助于设计针对不同疾病状态下诱导或抑制铁死亡的药物。本研究发现,铁死亡抑制剂liproxstatin-1(Lip-1)通过灭活溶酶体铁发挥保护作用。基于此,该研究设计了双功能化合物芬托霉素(fentomycin):该分子既能靶向质膜磷脂,又能在内吞后激活溶酶体铁,促进磷脂氧化降解并诱发铁死亡。fentomycin可有效杀伤原发性肉瘤和胰腺导管腺癌细胞,其作为脂解靶向嵌合体,能选择性靶向富含铁的CD44高表达细胞亚群——该亚群与转移性疾病和耐药性密切相关。进一步研究证实,fentomycin在体内同样能清除CD44高表达细胞,并在免疫健全的乳腺癌转移小鼠模型中抑制淋巴结内肿瘤生长。这些数据不仅证明溶酶体铁可触发铁死亡,更揭示了利用溶酶体铁氧化还原反应实现治疗干预的可行性,相关研究成果于2025年5月发表于《Nature》:Activation of lysosomal iron triggers ferroptosis in cancer。

1. 溶酶体铁触发铁死亡
研究人员从抑制铁死亡的分子入手,先确定Lip-1的亚细胞作用位点,对含有炔烃的Lip-1合成类似物(命名为cLip-1)在HT-1080纤维肉瘤细胞中进行细胞内标记,通过点击化学反应结合荧光显微镜观察显示其具有溶酶体靶向性。体内实验表明,cLip-1能够延缓因Gpx4基因缺失而诱发急性肾衰竭的小鼠死亡。在小鼠组织中标记cLip-1发现,该化合物在肝脏和肾脏中富集,并在肾近端小管中与溶酶体标志物共定位。这些数据说明cLip-1可作为Lip-1的合适替代物,用于研究铁死亡。核磁共振(NMR)光谱分析和目视检测表明,Lip-1能与铁离子形成复合物,这些复合物在溶酶体等酸性环境(如pH<5)中保持稳定,但在较高pH值(pH>12)下会解离。循环伏安法实验表明,Lip-1与去铁胺(deferoxamine,DFO)均能显著抑制铁的氧化还原活性。DFO和Lip-1均可诱导原代人胰腺导管腺癌(PDAC)细胞中的铁蛋白和铁调节蛋白2(IRP2)发生降解,这一现象表明,当这两种化合物与溶酶体铁结合后,会耗竭细胞内可利用的铁池,从而为它们在高浓度下产生的毒性作用提供理论依据。使用羟氯喹(HCQ)或巴弗洛霉素A1(Baf-A1)处理可提高溶酶体pH值,并阻止铁离子从其内吞载体上卸载,从而导致游离溶酶体铁离子池减少,并保护细胞免受RSL3(一种谷胱甘肽过氧化物酶4的抑制剂,能够抑制半胱氨酸和谷氨酸酯转运蛋白,也是一种铁死亡的激活剂)诱导的膜脂氧化。RSL3处理1小时,膜脂氧化的信号主要发生在溶酶体,但如果延长处理时间到4小时,膜脂氧化的信号则在内质网(ER),这强有力地表明,自由基链式反应最早起始于溶酶体区室——该区域存在具有氧化还原活性的铁离子,随后,这一链式反应会进一步扩散至其他邻近细胞器(如ER)的膜脂结构。这些数据共同阐明了溶酶体铁作为铁死亡触发器的中心作用。
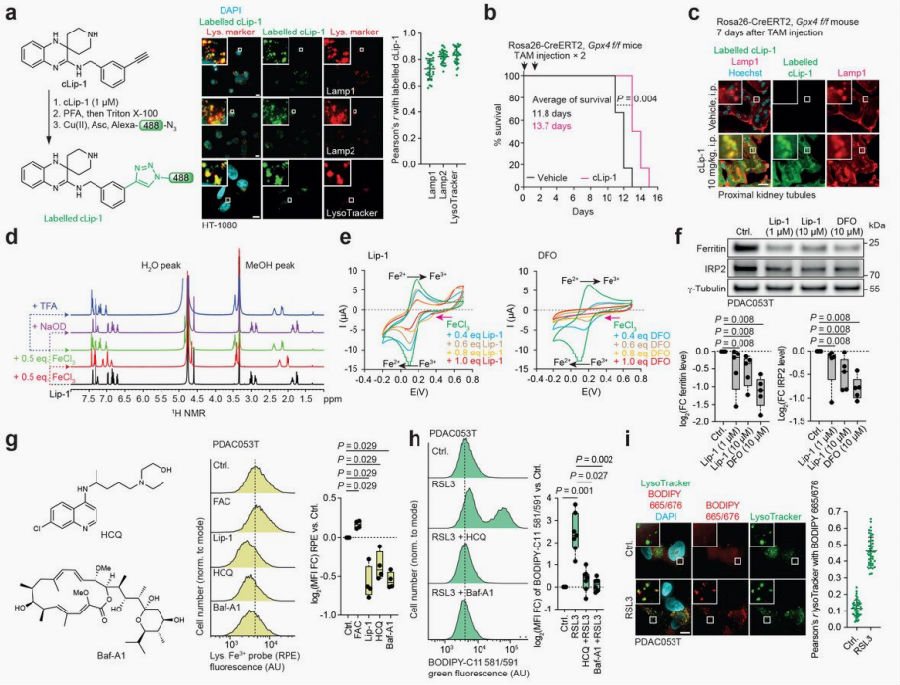
图1. 溶酶体铁触发铁死亡
(图片源自《Nature》)
2. 靶向脂质分解嵌合体的开发
既然溶酶体铁是触发铁死亡的关键,那么能否设计一个分子,特异性地靶向并激活溶酶体铁的氧化活性呢?研究团队将荧光亲脂性天然产物马尔霉素A(marmycin A)与合成的White-Chen配体相结合,并将其命名为fentomycin。在无细胞系统中,fentomycin在与溶酶体相当的实验条件下(酸性环境、H2O2、亚铁离子)增强了铁诱导的脂质体氧化。fentomycin的自身荧光特性显示,其在低温条件下与CD44共同定位于细胞膜上,重现了母体化合物marmycin A的光物理性质。相比之下,在生理温度条件下,fentomycin和marmycin A被发现靶向溶酶体区室,而含炔烃的White-Chen(cWhite-Chen)配体在酸性环境下能激活亚铁离子的催化氧化活性。与膜脂氧化现象一致,亚致死剂量的fentomycin导致HT-1080细胞中铁死亡抑制因子GPX4和SLC7A11等水平升高;诱导4-羟基壬烯醛(4-HNE)(4-HNE能够引发细胞损伤,其产生是铁死亡的典型标志)的产生。延长fentomycin处理时间会上调激素敏感脂肪酶(HSL)并伴随溶血磷脂和甘油的增加,说明氧化磷脂触发了细胞膜重塑。fentomycin诱导的细胞死亡可被公认的铁死亡抑制剂(包括铁螯合剂和抗氧化剂)所拮抗,但凋亡或坏死性凋亡抑制剂则无效。这些数据共同表明,通过药物手段激活溶酶体铁可以触发铁死亡,而fentomycin正是作为一种“脂解靶向嵌合体”发挥作用。

图2. 靶向脂质分解嵌合体的开发
(图片源自《Nature》)
3. fentomycin诱导癌症中的铁死亡
接下来,评估溶酶体铁激活在疾病相关模型中的影响。为此,我们研究了不同癌症类型原发肿瘤组织中铁的含量,包括PDAC、多种人类肉瘤亚型以及自发性乳腺癌转移的小鼠模型。电感耦合等离子体质谱(ICP-MS)分析显示,与同一患者癌旁非癌组织相比,癌组织的总铁含量更高,并且过表达CD44的癌细胞亚群中铁负荷水平更高。对新鲜分离的PDAC和肉瘤组织细胞的研究显示,与CD44低表达的癌细胞亚群相比,CD44高表达亚群中具有氧化还原活性的溶酶体亚铁离子水平更高。这一结果与先前的研究发现一致,即CD44可介导癌细胞通过内吞作用摄取铁,从而获得药物耐受的持续存留表型。在从新鲜分离的人原发性肿瘤获得的细胞中,fentomycin诱导膜脂氧化和脂解,这种效应被铁死亡抑制剂拮抗,值得注意的是,fentomycin还可减少PDAC和未分化多形性肉瘤(UPS)中的CD44高表达细胞数量,这同样被铁死亡抑制剂拮抗。在原代PDAC细胞和人PDAC衍生类器官中,与标准治疗药物相比,fentomycin对细胞活力的影响更显著。这些CD44高表达细胞在溶酶体中还表现出更强的亚铁离子依赖性氧化还原活性,并且在体外实验中,fentomycin能够改变细胞活力,而这一效应可被铁死亡抑制剂Lip-1所拮抗。在4T1细胞荷瘤小鼠模型中,发现fentomycin治疗可显著抑制肿瘤生长,对残留肿瘤的进一步分析表明,fentomycin能诱导膜脂氧化和溶血磷脂的产生,并且对CD44高表达癌细胞亚群的作用明显强于CD44低表达亚群。这些数据说明fentomycin通过靶向CD44高表达细胞亚群中更丰富的溶酶体亚铁离子,在体内诱导铁死亡。

图3. fentomycin诱导癌症中的铁死亡
(图片源自《Nature》)
云克隆公司助力科学研究,为广大科研人员提供相关检测试剂产品,相关靶标核心货号如下:
靶标 | 核心货号 | 靶标 | 核心货号 |
ACSL4 | D674 | AIFM2 | G247 |
Catalase | C418 | CD3d | B872 |
CD3e | D117 | CD31 | A363 |
CD44 | A670 | CD45 | B030 |
CD163 | B726 | Cyt-C | A594 |
EEA1 | J176 | Ferritin | A518 |
GPX4 | C994 | HSL | B276 |
IRP2 | H789 | Lamp1 | B441 |
PDIA3 | B497 | TfR1 | B171 |