Nature揭秘——肠道炎症如何“远程操控”大脑炎症
肠道微生物群被认为是多种疾病的重要驱动因素。大量研究表明,在炎症性肠病和神经退行性疾病中,肠道微生物群的组成会发生显著改变。微生物群的变化可通过调控特定代谢产物进入血液循环,进而产生系统性影响。此外,肠道微生物群还具有免疫调节功能,能够影响先天性和适应性免疫反应。然而,微生物群如何导致中枢神经系统(CNS)炎症仍不清楚,尤其是在CNS通常不存在微生物的情况下。最近发表在《Nature》的研究“Gut inflammation promotes microbiota-specific CD4 T cell-mediated neuroinflammation”发现识别肠道共生分段丝状细菌(SFB)的TCR7B8CD4 T细胞在缺乏调节性T细胞(Treg)的情况下,可同时诱发肠道和CNS的炎症反应。研究揭示SFB特异性T细胞在“肠-脑轴”炎症中的关键作用,并提示SFB抗原驱动的T细胞可能通过分子模拟促进自身免疫性神经炎症。

SFB通过调控T细胞赋予其致病潜能
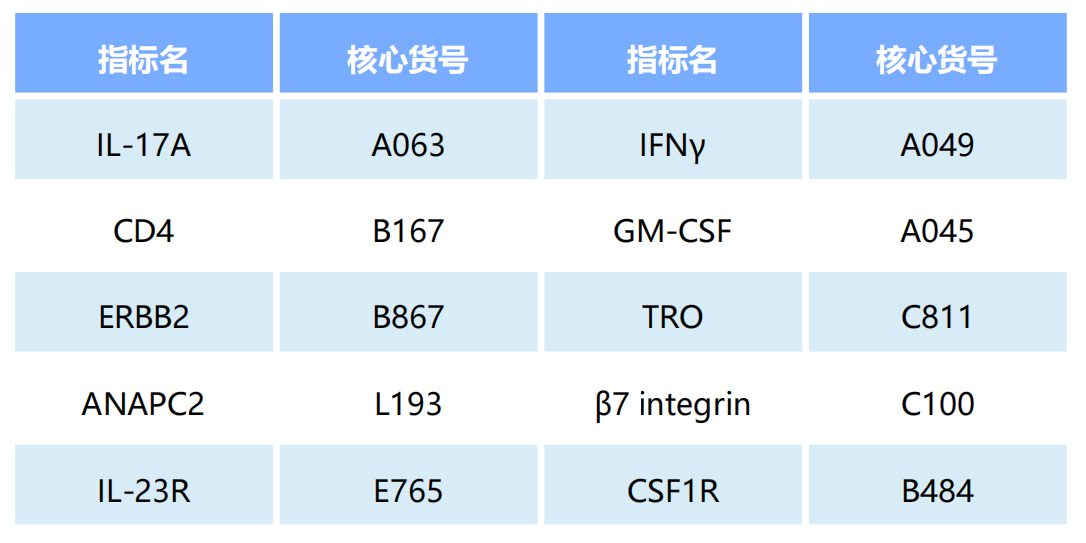
研究团队将TCR7B8CD4 T细胞移植入Rag2⁻/⁻小鼠体内,在缺乏Treg的情况下,TCR7B8CD4 T细胞在SFB抗原刺激下分化为具有致病性的IL-17A⁺IFNγ⁺T细胞。值得注意的是,IL-17A⁺IFNγ⁺T细胞不仅引发了肠道炎症,还会向脑部迁移,导致实验小鼠出现共济失调、后肢瘫痪等典型神经症状。免疫荧光分析显示,TCR7B8CD4 T细胞可以深入脑组织,主要聚集在脑干和丘脑区域,并形成特征性的炎症细胞簇。对比实验显示,具有Treg细胞的Rag2⁻/⁻小鼠仅表现出轻微的神经症状,这一结果突显了Treg在抑制CNS炎症反应中的保护作用。进一步的实验发现,当研究人员采用阿莫西林清除SFB后,实验小鼠不再出现神经症状,且T细胞向脊髓的迁移被完全阻断;而在无菌条件下特异性定殖SFB的实验组小鼠会重现CNS炎症表型,并检测到T细胞产生IFNγ和IL-17A。这些关键证据充分表明,SFB抗原是驱动TCR7B8CD4 T细胞在CNS中激活和扩增的必要条件,这种异常的免疫应答不仅会导致肠道炎症,还能诱发严重的神经炎症反应(图1)。
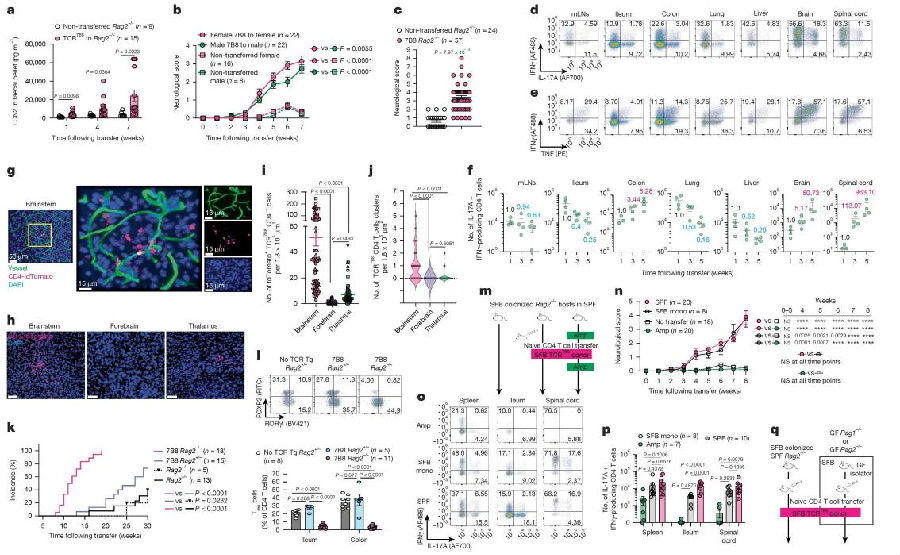
图1. SFB抗原驱动的TCR7B8CD4 T细胞在肠道及CNS中扩增并发挥致病作用
(图片来源于《Nature》杂志)
TCR7B8CD4 T细胞在CNS被再次激活
由于血脑屏障的严格调控,健康脑组织和脊髓中CD4 T细胞的浸润极少,这显著限制了自身反应性T细胞介导的神经炎症风险。研究团队将TCR7B8CD4 T细胞或TCRVβ14细胞(即SFB特异性T细胞的主要亚群,包括TCR7B8CD4 T细胞)缺失的CD4 T细胞(TCRbulk−Vβ14CD4 T细胞)分别输入SFB定植的Rag2⁻/⁻小鼠后,两组实验小鼠均出现了结肠炎和神经系统症状,但值得注意的是,单独移植TCR7B8CD4 T细胞组小鼠即使结肠炎程度较轻,神经系统症状却更严重。进一步分析发现,TCRbulk-Vβ14组小鼠CNS中的CD4 T细胞数量显著低于TCR7B8CD4 T细胞组。与神经症状的严重程度一致,TCR7B8CD4 T细胞表现出强烈的IL-17A和GM-CSF应答,而TCRbulk-Vβ14CD4 T细胞则无此反应,提示TCR7B8 CD4 T细胞在CNS中被特异性再激活(图2)。关键的是,当出现神经症状的TCR7B8CD4 T细胞组小鼠接受氨苄青霉素清除SFB后,其神经评分并未降低。这进一步证实,TCR7B8CD4 T细胞能够在CNS中被再激活并维持长期的炎症反应,且不依赖于持续的SFB抗原刺激。
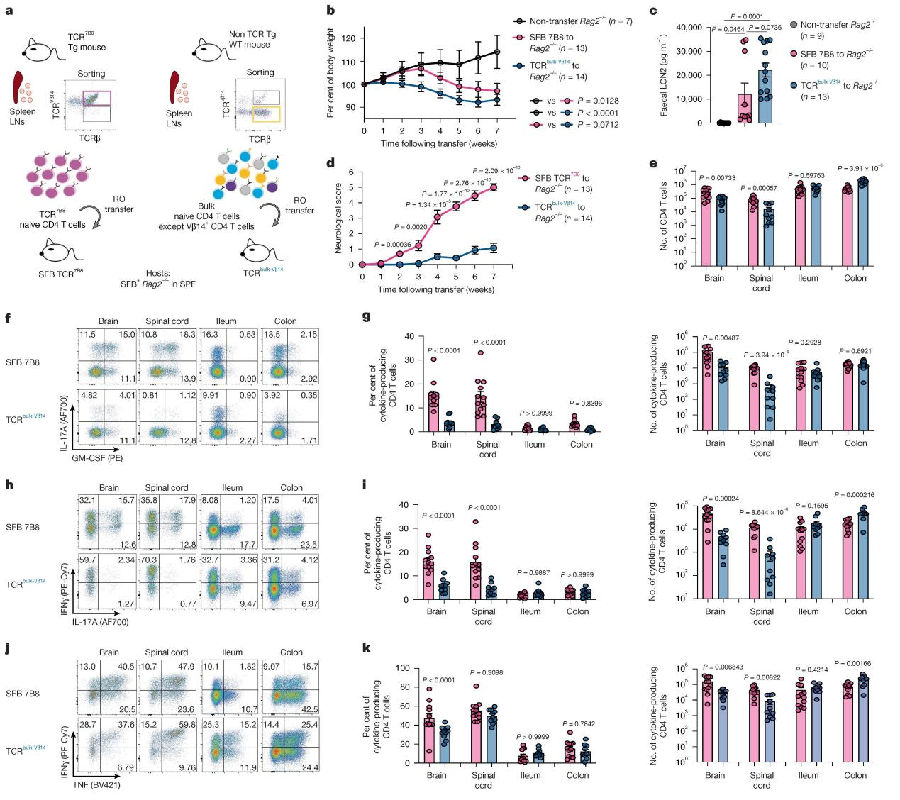
图2. 肠道炎症通过非TCR特异性方式促使TCR7B8CD4 T细胞的特异性再激活
(图片来源于《Nature》杂志)
TCR7B8CD4 T细胞识别宿主神经蛋白引发CNS炎症
接下来,研究团队分别将TCR7B8CD4 T细胞或TCR1A2T细胞转移到同样的Rag2⁻/⁻小鼠。尽管TCR1A2能识别与TCR7B8相同的SFB蛋白表位区域,不同于TCR7B8CD4 T细胞组出现了明显的神经系统症状,TCR1A2T细胞组小鼠仅出现了肠道炎症,没有表现出任何神经系统症状,大脑中几乎没有TCR1A2T细胞的浸润。深入研究发现,TCR7B8特异性识别八肽FSGAVPNK,而TCR1A2则仅对九肽QFSGAVPNK产生应答。通过比对,研究团队发现氨基酸序列与TCR7B8识别的SFB抗原片段(FSGAVPNK)相似的宿主蛋白,包括受体酪氨酸激酶(ERBB2)、滋养层蛋白(TRO)和后期促进复合物亚基2(ANAPC2)等。这些蛋白都在CNS中有很高的表达。同时体外实验证实,ERBB2、TRO1和ANAPC2的肽段,都成功地激活了TCR7B8CD4 T细胞。TCR7B8CD4 T细胞之所以能够在大脑组织中引发异常免疫反应,其机制并非源于对SFB的特异性识别,而是发生了抗原识别错误,将在肠道微环境中习得的针对SFB的免疫应答模式,错误地迁移至CNS,误将结构相似的自身神经蛋白识别为攻击靶点,从而触发了一系列致命的自身免疫反应过程。(图3)
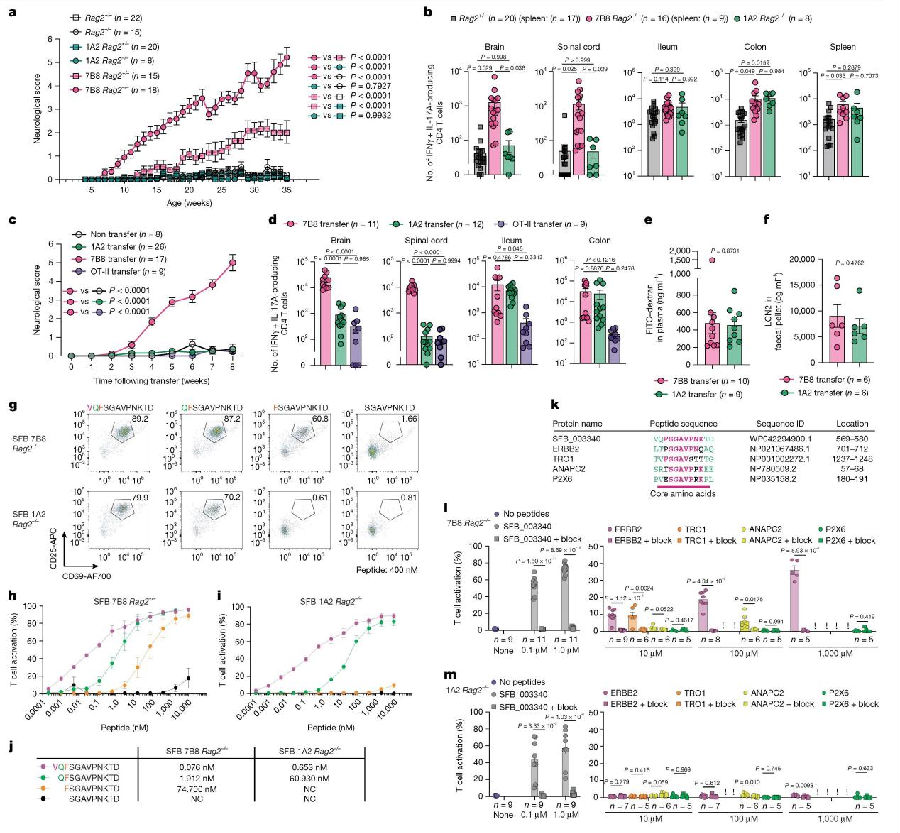
图3. TCR7B8通过识别交叉反应性宿主蛋白促进CNS炎症的发生
(图片来源于《Nature》杂志)
肠道炎症加速CNS炎症进程SFB特异性T细胞主要在肠系膜淋巴结中生成,随后依赖β7 integrin(由Itgb7基因编码)迁移至肠道固有层。研究团队将等比例混合的Itgb7+/−TCR7B8CD4 T细胞和Itgb7−/− TCR7B8CD4 T细胞到Rag2⁻/⁻小鼠。结果发现Itgb7−/− TCR7B8CD4 T细胞组小鼠表现出肠道炎症和CNS炎症显著减轻。转移8周后,CNS中Itgb7+/−TCR7B8CD4 T细胞的检出频率也高于缺陷型细胞。这些数据表明,肠道炎症环境可促进肠道TCR7B8CD4 T细胞向CNS的浸润,并加速其介导的CNS炎症。(图4)
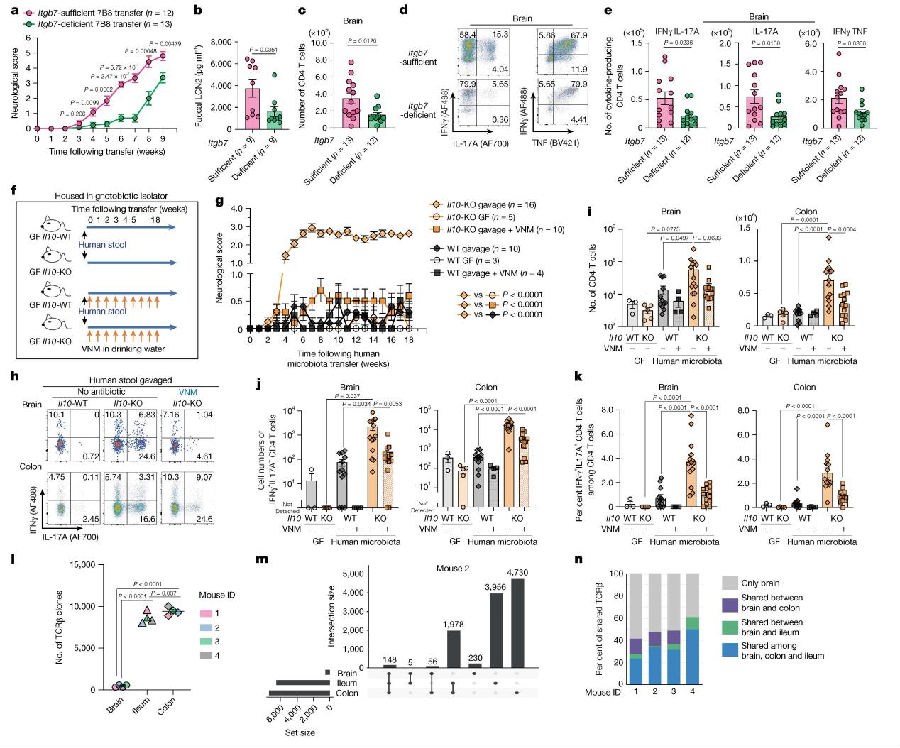
图4. 肠道炎症加速肠道共生菌特异性CD4 T细胞向CNS的浸润
(图片来源于《Nature》杂志)
IL-23R与GM-CSF协同促进CNS炎症发生
最后研究团队锁定了两种关键信号分子:1)IL-23R,由Il23r基因编码,位于致病性TH17细胞表面,在多种组织炎症和自身免疫病中调控其致病性;2)GM-CSF,由Csf2基因编码,由T细胞分泌并能激活大脑中小胶质细胞诱发炎症。对比TCR7B8CD4 T细胞组小鼠,敲除Il23r的TCR7B8CD4 T细胞组小鼠的肠道炎症未减轻,神经症状显著延迟但最终发展为CNS炎症;敲除Csf2的TCR7B8CD4 T细胞组小鼠神经症状也显著延迟,最终也会发展为CNS炎症;而同时敲除Il23r和Csf2的TCR7B8CD4 T细胞组小鼠未出现CNS炎症。另外,PLX5622(CSF1R抑制剂)处理的Rag2⁻/⁻小鼠因小胶质细胞缺失而未发生TCR7B8CD4 T细胞介导的神经炎症,这一结果明确了小胶质细胞在TCR7B8CD4 T细胞介导CNS炎症中的关键性作用。(图5)
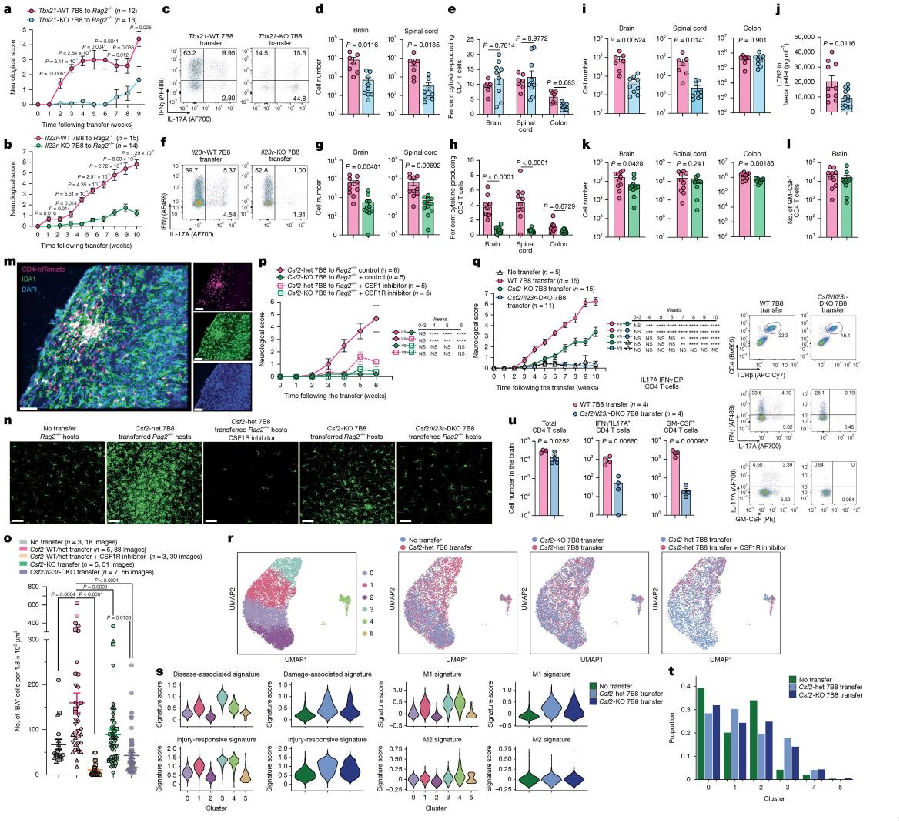
图5. IL-23R与GM-CSF在TCR7B8 CD4 T细胞中的共同导致CNS炎症
(图片来源于《Nature》杂志)
云克隆相关产品
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、试剂盒等产品以助力相关研究,部分指标节选如下,供参考: