蛋白激酶在神经退行性疾病发病机制中的作用(一)
神经退行性疾病(如阿尔茨海默病、帕金森病、亨廷顿病和肌萎缩侧索硬化症)是老年人群面临的主要健康威胁,且随着预期寿命的增加,其患病率持续上升。迄今为止仍缺乏有效的治疗方法,深入了解这些神经退行性疾病的分子和细胞机制对于药物研发至关重要。药理和病理学研究表明,蛋白激酶被证实是多种疾病(如癌症、中枢神经系统疾病和心血管疾病)中具有前景的治疗靶点。本文总结蛋白激酶在神经退行性疾病发病机制中的作用,阐述蛋白激酶抑制剂在临床应用上的进展。

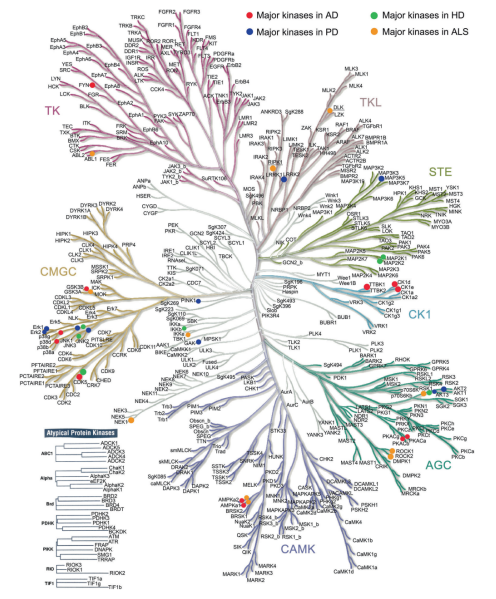
迄今为止,已鉴定出478种典型(包含真核蛋白激酶结构域)激酶和40种非典型激酶。根据蛋白激酶结构域序列相似性,典型激酶可进一步分为八类,即酪氨酸激酶组(TK)、酪氨酸激酶样激酶组(TKL)、细胞周期蛋白依赖性激酶(CDK)、丝裂原活化蛋白激酶(MAPK)、糖原合成酶激酶(GSK)、细胞分裂周期样激酶家族组(CMGC)、酵母Sterile 7、Sterile 11和Sterile 20激酶的同源物组(STE)、包含cAMP依赖性蛋白激酶(PKA)、cGMP依赖性蛋白激酶(PKG)、蛋白激酶C(PKC)家族组(AGC)、钙调蛋白依赖性蛋白激酶组(CAMK)、酪蛋白激酶1(CK1)组以及其他组。(见图1)
阿尔茨海默病(AD)的病理特征包括神经原纤维缠结(NFTs,由tau蛋白聚集形成)、细胞外老年斑(SPs,由β淀粉样蛋白(Aβ)聚集形成)、神经胶质增生、萎缩性神经突,伴有脑血管淀粉样变性、神经元丢失、金属调节紊乱以及突触改变。AD中关键蛋白激酶的主要作用如下(见图2):
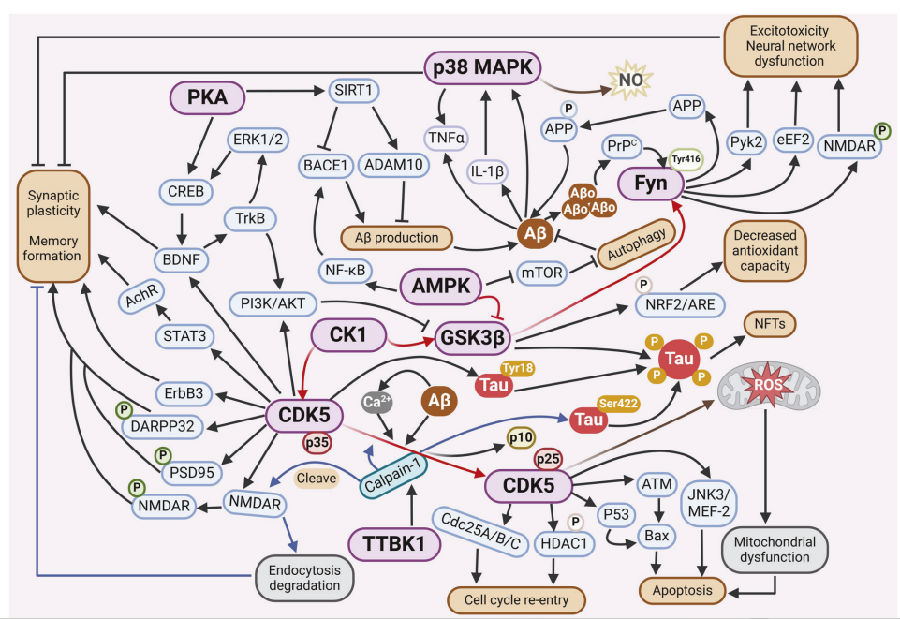
GSK3β(糖原合成酶激酶3):AD患者外周血中的GSK3β活性与痴呆程度呈正相关。GSK3β主要影响Aβ的形成、tau病理、神经元存活与凋亡、氧化应激以及神经炎症。在AD动物和细胞模型中,GSK3β通过促进APP(淀粉样前体蛋白)的磷酸化,加剧APP的β切割,减少溶酶体的生成来抑制APP的自噬降解,从而增加Aβ水平。在NFTs形成过程中,GSK3β通过在Thr231位点特异性磷酸化tau,加速tau从微管上解离,促进tau二聚体化和NFTs的形成。在GSK3β转基因小鼠出现超磷酸化的tau蛋白、Aβ积累增加、反应性神经胶质增生、神经元死亡、氧化应激增强以及认知缺陷时,通过注射GSK3β抑制剂使症状得到逆转,表明GSK3β是抑制AD进程的一个有力靶点。
CDK5(细胞周期素依赖蛋白激酶5):从机制上讲,CDK5由其神经特异性且膜定位的激活剂p35和p39激活,这两种激活剂分别被钙蛋白酶切割为p25和p29。CDK5/p25复合物通过磷酸化p53来增强p53的活性,并促进由p53-Bax引发的神经元凋亡。研究表明,p35的泛素化和降解受己糖激酶2的调控,己糖激酶2的异常减少有利于将p35分解为p25,导致CDK5的过度激活,并干扰由GSK3β诱导的β-连环蛋白的降解,从而抑制细胞周期机制的激活。CDK5/p25与BM88(也称为细胞周期终止和神经分化蛋白1)相互作用并使其磷酸化,促进BM88的降解,上调动力蛋白相关蛋白1表达,导致5xFAD小鼠大脑中的线粒体功能障碍和神经元死亡。
CK1:在持续表达APP的N2a细胞(N2A-APP695细胞)中,CK1ε的过度表达会导致Aβ的生成量增加,而CK1抑制剂能够阻止β-分泌酶对APP的切割作用,但不会影响Notch的切割过程。在炎症反应中,CK1会通过细胞外囊泡从星形胶质细胞传递到神经元,从而促进APP的翻译和淀粉样蛋白生成过程。除了直接参与AD的病理过程外,CK1还作为其他关键激酶(如GSK3β)的启动型激酶发挥作用。CK1对GSK3β的磷酸化和激活会导致Aβ和tau蛋白过度磷酸化,从而加重AD的病理过程。CK1还在CDK5的上游发挥作用,并调节其活性和下游信号。由于目前CK1激酶抑制剂主要通过作用于ATP结合位点发挥功效,而这些位点在CK1各亚型中具有高度的保守性。因此,这类抑制剂的特异性较低,针对AD的药物设计仍颇具挑战性。
PKA:在AD中,钙离子失调会通过过度激活钙蛋白酶导致蛋白激酶A(PKA)亚基的降解增加,从而降低PKA的活性,并随后下调转录因子cAMP 响应元件结合蛋白(CREB)的磷酸化以及脑源性神经营养因子(BDNF)的表达。β-分泌酶1(BACE1)的过度表达会在其跨膜结构域与环磷酸腺苷(cAMP)相互作用,降低cAMP水平、PKA的激活以及CREB的磷酸化,导致AD中cAMP/PKA/CREB信号通路受损进而产生认知障碍。衰老抑制因子1(SIRT1)在被激活的cAMP/PKA信号通路磷酸化后发挥去乙酰化酶活性,并在APP过度表达的细胞和动物模型中上调ADAM10,下调BACE1以防止Aβ的生成。综上所述,提高PKA活性以调节下游CREB和SIRT1信号传导可能对阿尔茨海默病有益。
p38 MAPK:在神经胶质细胞和神经元中,Aβ刺激小胶质细胞会激活p38 MAPK信号通路,以促进IL-1β和TNF-α分泌,从而导致慢性炎症。随后IL-1β也会激活神经元和星形胶质细胞中的p38 MAPK信号通路,导致星形胶质细胞中产生促炎性介质。与p38α-MAPK不同的是,p38γ-MAPK特异地定位在神经元的突触后区域,并介导突触后tau蛋白在Thr205位点的磷酸化。Thr205位点的磷酸化促进了tau蛋白从PSD95/NMDAR(突触后致密蛋白95/N-甲基-D-天冬氨酸受体)复合物的清除,PSD95与tau的解离进一步使tau与下游因子(如Fyn和ERK)分离,从而抑制NMDAR下游的毒性信号,如Aβ兴奋性毒性。这些结果表明,p38 MAPK的激活与Aβ清除缺陷、Aβ诱导的神经兴奋毒性以及tau磷酸化显著相关。然而,针对p38 MAPK靶点开发药物时,可能需要考虑特定的亚型。
Fyn(酪氨酸蛋白激酶):在AD的发病机制中,Fyn的过度激活会促使APP在Tyr 682位点和tau在Tyr 18位点发生磷酸化,导致Aβ和NFTs增多。胞外Aβ低聚体与胞内朊蛋白结合会刺激Fyn在Tyr420位点的磷酸化,并激活Fyn,从而引发由NR2B/NMDAR的磷酸化、eEF2和蛋白酪氨酸激酶2β的持续激活所导致的病理信号级联反应和兴奋性毒性。另外,Fyn对NR2B的磷酸化能够增强 PSD95与NMDAR的结合,从而增加NMDAR复合物中的tau水平。使用Src家族激酶抑制剂(如AZD0530)抑制Fyn,被证明能够缓解APP/PS1小鼠的空间记忆缺陷和突触密度损失,并且能够缓解3xTg-AD小鼠中tau磷酸化和沉积的异常,这表明Fyn是治疗AD的有力靶点。
TTBK1:TTBK1是中枢神经系统特异性激酶,在AD患者额叶皮质中显著上调,可直接磷酸化tau的Ser422位点,促进tau聚集。在TTBK1转基因小鼠体内,发现CDK5共激活蛋白p35和p25的含量升高,同时calpain-1(钙蛋白酶1)的活性以及p35/CDK5的活性也有所增加,这表明TTBK1能激活CDK5以触发下游信号级联反应。p35/CDK5和calpain-1密切调节NMDAR亚基NR2B在膜表面的周转,并影响海马体的空间学习和长时程增强。
AMPK:是一种能量感知激酶,通过降低GSK3β的活性来减轻tau蛋白磷酸化,诱导SIRT1活性,使tau蛋白去乙酰化,并随后导致其降解。在AD中,能量代谢的紊乱会调节大脑中的AMPK活性,一方面会增加mTOR的磷酸化并抑制自噬;另一方面会减少SIRT1的激活,从而导致Aβ的生成增加和tau蛋白的磷酸化加剧。
目前针对AD靶向蛋白激酶的药物有:
p38αMAPK抑制剂:如MW150,通过抑制神经炎症缓解病理症状。VX-745,可降低脑脊液tau水平,抑制神经炎症,但未改善认知。
GSK3抑制剂:如Tideglusib,可减少tau磷酸化,但短期治疗无临床获益;锂盐,可降低Aβ沉积,但存在神经毒性风险。
TK抑制剂:如Masitinib,靶向Fyn,可改善认知;Nilotinib,能够促进Aβ清除。
Table 1 临床试验中涉及神经退行性疾病的靶向蛋白激酶药物
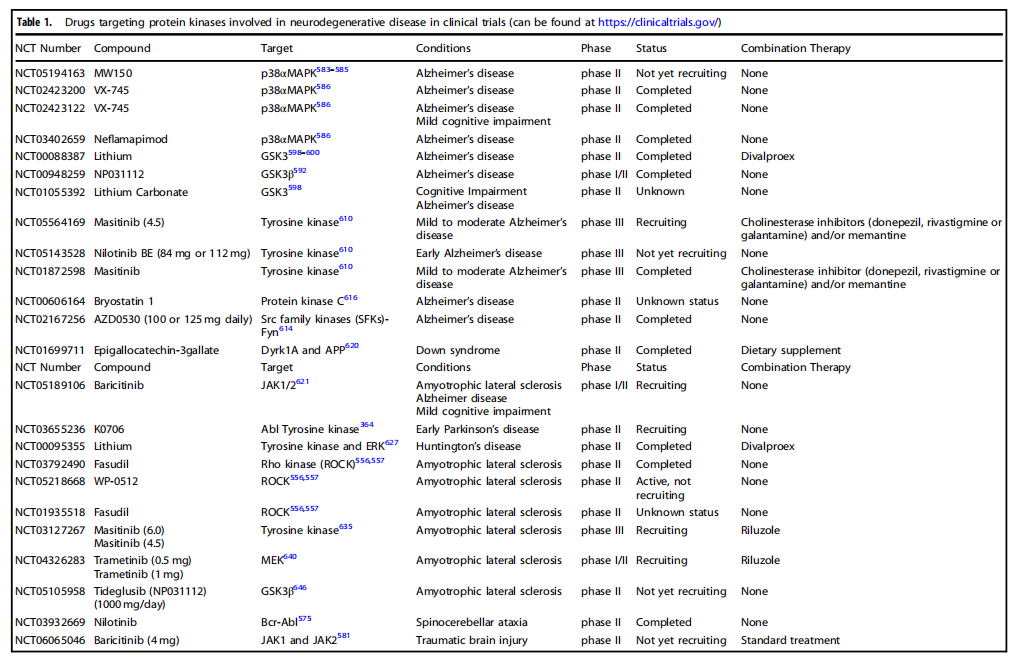
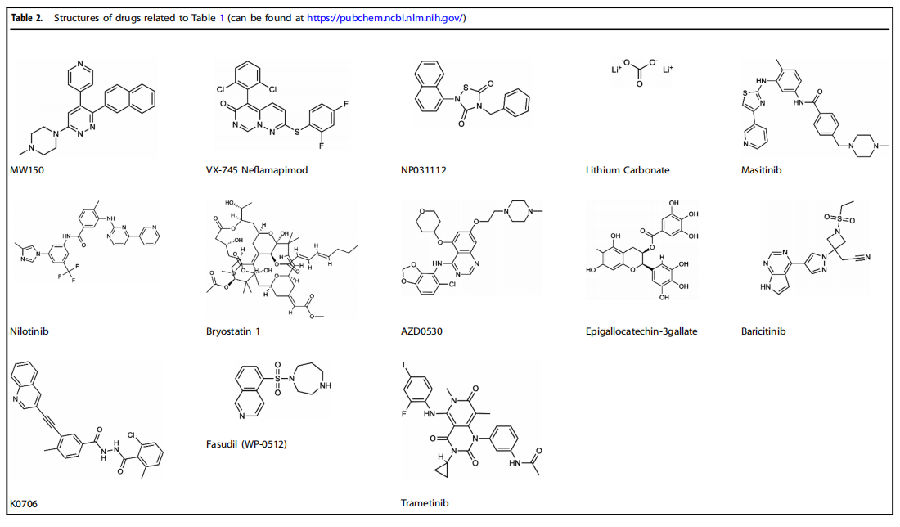
Table 2 药物结构
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关研究,部分指标节选如下,供参考。
指标名 | 核心货号 | 指标名 | 核心货号 |
GSK3β | D317 | CDK5 | A739 |
AMPK Alpha 1 | A679 | PRKAa2 | D357 |
B435 | D577 | ||
D578 | B206 | ||
TTBK1 | B984 | TTBK2 | E723 |
Fyn | K247 | CSNK1d | D345 |