肿瘤源性CCL16诱导肿瘤血管正常化增强肝癌免疫治疗
2025年8月南方医科大学研究团队在《Cancer Research》发表了题为“Tumor-derived CCL16 Normalizes Tumor Vasculature through Macrophage ICAM-1 Receptor and Enhances Immunotherapy Efficacy in Hepatocellular Carcinoma”的文章。

肝细胞癌(HCC)以异常肿瘤血管和免疫抑制性肿瘤微环境(TME)为特征,这两者不仅会削弱免疫治疗效果,还会促进循环肿瘤细胞(CTC)扩散和免疫逃逸。本研究通过体内外实验证实,CCL16缺失会加剧血管功能障碍和免疫抑制性TME形成,而过表达CCL16可介导血管正常化(TVN)并促进免疫细胞浸润。机制上,CCL16与肿瘤相关巨噬细胞上的ICAM-1受体相互作用,触发JAK2-STAT6通路激活并诱导IL-24分泌。使用DPP4抑制剂(西格列汀)进行药物干预,可通过防止CCL16降解,有效稳定肿瘤血管。重要的是,提升CCL16水平联合抗PD1抗体给药,在HCC模型中协同增强血管正常化并改善抗肿瘤免疫,从而抑制肿瘤生长。这些发现确立了CCL16作为血管-免疫互作的关键调节因子,并提出DPP4抑制是治疗HCC的潜在策略。

图1. CCL16-ICAM1-JAK2/STAT6-IL24信号轴在肝癌血管免疫调控中的核心作用
(图片源于《Cancer Research》)
该研究中使用的CCL16、VEGF-A和ANG-2 ELISA kits均来源于云克隆。

1. 多组学分析鉴定出介导HCC中血管-免疫互作的关键枢纽分子
CTC可作为HCC转移的早期标志物,异常的肿瘤血管系统和免疫抑制性TME促进了CTC侵入脉管系统及其远处播散。CD31+α-SMA+血管密度增加提示血管完整性改善和肿瘤血管系统正常化。研究发现高CTC(CTC-high)组CD31+α-SMA+显著降低,同时CD86+抗肿瘤巨噬细胞、CD8+ T细胞和NK细胞浸润明显减少,说明CTC-high负荷的HCC组织具有血管结构异常和免疫抑制性TME的特征,二者协同作用构成了CTC免疫逃避的核心驱动机制。通过高通量测序、数据集整合及蛋白互作网络分析发现CCL16是核心模块中的关键基因之一,提示CCL16可能是TME中血管-免疫交叉对话的潜在调控因子。研究人员构建了CCL16敲低的Hepa1-6细胞系,体内外结果均表明CCL16是协调HCC肿瘤血管重塑和TIME(肿瘤免疫微环境)相互作用的关键介质。
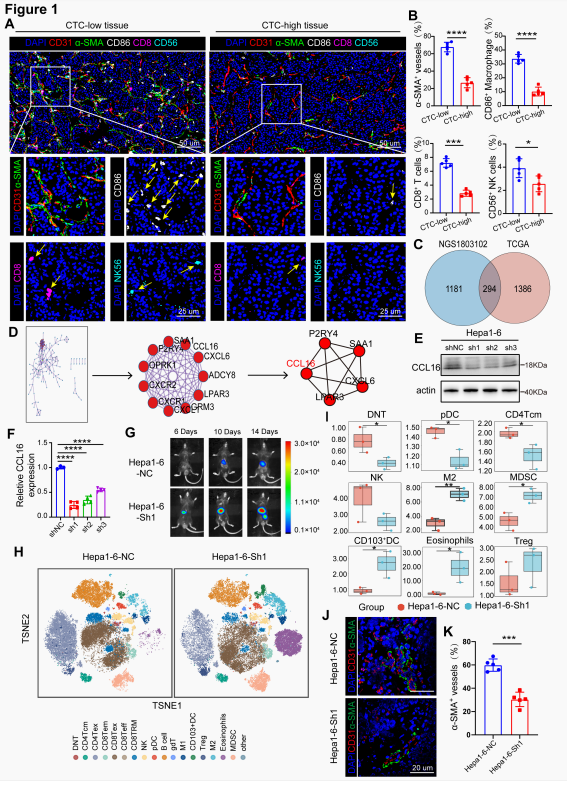
图2. CCL16是HCC中血管-免疫互作的关键枢纽分子
(图片源于《Cancer Research》)
2. CCL16促进TVN并逆转HCC中的免疫抑制性肿瘤微环境
为进一步阐明CCL16在HCC中的作用,构建了CCL16过表达的Huh7细胞(LV-CCL16)及对照细胞(LV-Ctrl)。在裸鼠皮下移植瘤模型中,LV-CCL16组的肿瘤生长速度和瘤体重量显著慢于LV-Ctrl组,且表现为α-SMA+周细胞覆盖率升高和lectin+CD31+功能性血管比例显著增加,表明CCL16能促进肿瘤血管形成更稳定、功能更完善的结构,该结论在CCL16敲低模型中得到进一步验证。研究团队进一步探讨外源性重组CCL16(rCCL16)在调控肿瘤血管和TIME方面的治疗潜力,发现rCCL16显著抑制了HCC进展并提升了肿瘤血管灌注效率,同时肿瘤组织中效应免疫细胞浸润增加和调节性T减少。这些结果表明外源性CCL16通过双重机制发挥抗肿瘤作用——协同促进肿瘤TVN和免疫激活,为开发HCC血管-免疫双向调控治疗策略提供了新依据。
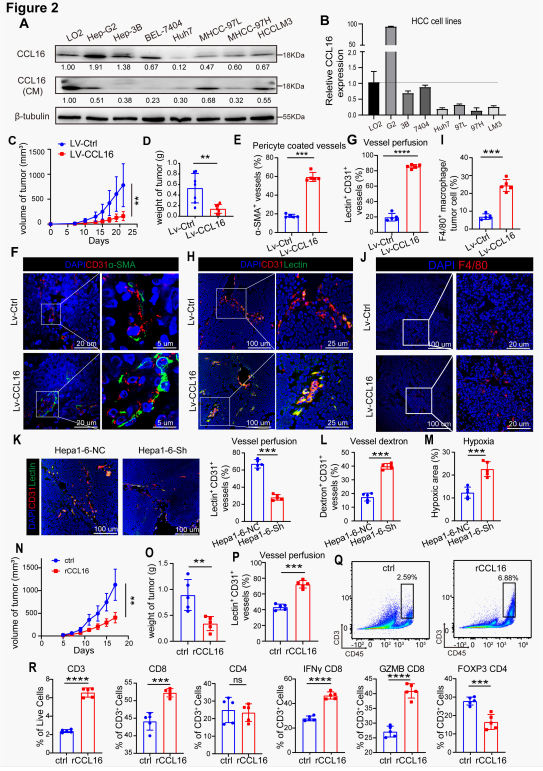
图3. CCL16促进TVN并逆转HCC中的免疫抑制性肿瘤微环境
(图片源于《Cancer Research》)
3. CCL16调控巨噬细胞介导的TVN
既往研究证实CCL16通过CCR1(C-C趋化因子受体1)受体信号传导发挥促血管生成作用,但使用CCR1拮抗剂(ZK811752)处理的LV-CCL16裸鼠皮下移植瘤模型显示肿瘤血管灌注仍然可以维持,即该效应不依赖于CCR1。TIMER免疫浸润分析发现CCL16表达与巨噬细胞浸润呈显著正相关,功能评估表明LV-CCL16+PBS处理可增强血管灌注、减少血管渗漏并改善组织供氧,而这些效应在巨噬细胞被清除后均消失。以上结果确立了巨噬细胞作为CCL16驱动TVN过程中不可或缺的介质。
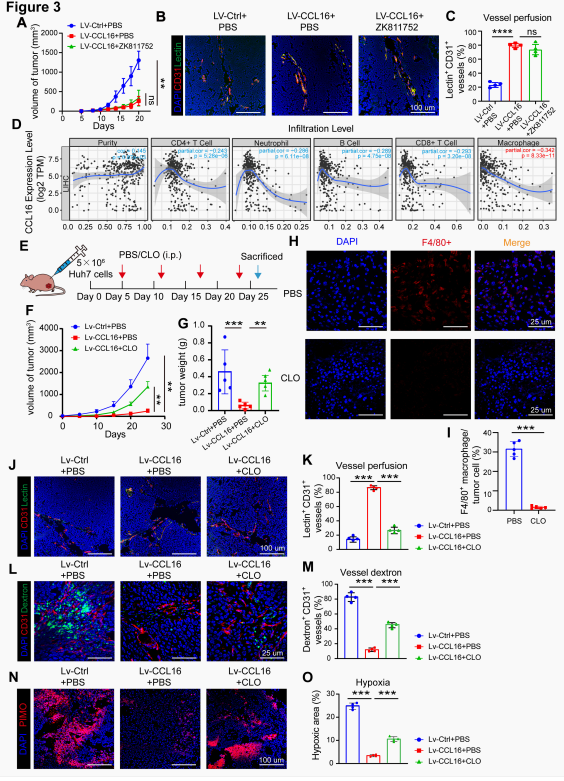
图4. CCL16调控巨噬细胞介导的TVN
(图片源于《Cancer Research》)
4. CCL16通过ICAM-1介导的分子机制促进巨噬细胞活化与TVN
rCCL16刺激的M0巨噬细胞的RNA测序发现包括IL24、IL36G、IL1A、IL1B、CXCL3、CXCL5和CXCL6在内的分泌因子显著上调,其中IL24诱导程度最高。在THP-1细胞中,ICAM-1阻断可完全抑制rCCL16驱动的IL24表达。免疫荧光和蛋白印迹显示rCCL16以时间依赖性方式诱导STAT6磷酸化,同时上调p-JAK2、p-STAT6和IL-24水平。这些效应可被ICAM-1抗体或STAT6抑制剂(AS1517499)逆转。体内实验进一步证实中和IL-24抗体、AS1517499或ICAM-1阻断会逆转CCL16过表达的抑瘤效应。这些结果阐明CCL16-ICAM-1-JAK2/STAT6-IL24轴是巨噬细胞驱动TVN和肿瘤抑制的核心机制。
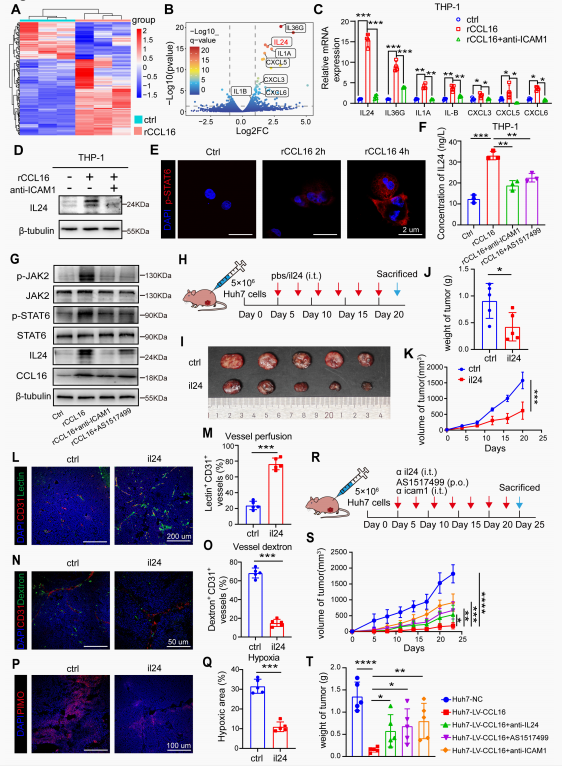
图5. CCL16通过ICAM-1介导的分子机制促进巨噬细胞活化与TVN
(图片源于《Cancer Research》)
5. CCL16在HCC微环境中的降解及DPP4抑制剂的治疗潜力
为探究CCL16在HCC中下调的机制,研究了致癌驱动因子是否促进CCL16降解。基于既往研究显示DPP4抑制剂可升高趋化因子CCL11的浓度,因此提出假设:在HCC中过表达的DPP4介导了CCL16的蛋白水解过程。分子对接预测显示DPP4与CCL16之间存在空间相互作用。在HCCLM3和HepG2细胞中过表达DPP4可显著降低胞内外CCL16水平,证实其降解作用,而DPP4抑制剂处理Huh7细胞后,胞内外的CCL16水平得以恢复,证明DPP4抑制剂能稳定CCL16。通过DPP4抑制剂处理的Huh7细胞条件培养基(CM)评估功能变化时发现,该CM能刺激M0巨噬细胞上调p-JAK2和p-STAT6,重新激活CCL16-ICAM1-JAK2/STAT6通路。皮下移植瘤模型显示DPP4抑制剂或rCCL16均可抑制肿瘤生长和重量,而抗CCL16抗体与DPP4抑制剂联合治疗则逆转该效应,证实DPP4抑制剂的疗效依赖于CCL16。功能学血管分析表明,DPP4抑制剂显著提升灌注效率、降低血管渗漏并缓解缺氧。这些效应与rCCL16介导的TVN作用相当,但在CCL16被阻断后基本消失。
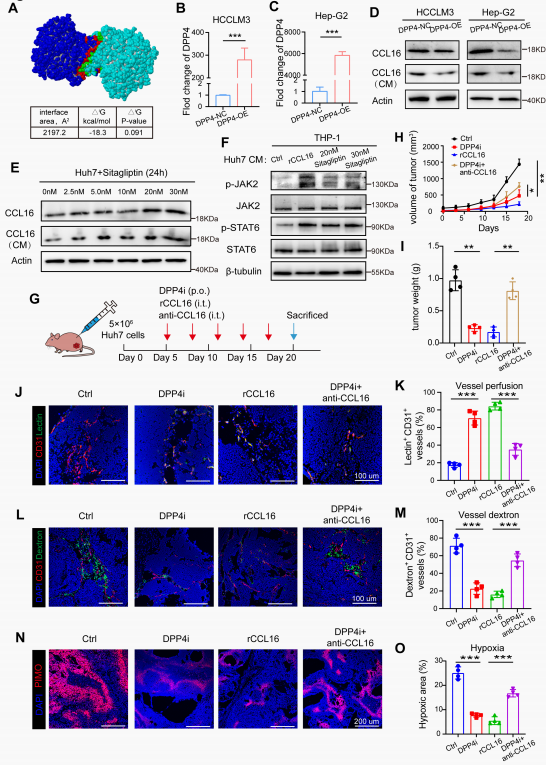
图6. CCL16在HCC微环境中的降解及DPP4抑制剂的治疗潜力
(图片源于《Cancer Research》)
6. CCL16在HCC中的临床意义及联合治疗策略探索
单纯TVN可能不足以在晚期HCC中实现最佳抗肿瘤疗效,因此评估其与抗PD-1免疫治疗的协同作用。体内实验采用慢病毒介导的LV-CCL16细胞系进行不同治疗方案干预,发现LV-CCL16诱导的TVN可适度增强抗肿瘤活性,效果与抗PD-1单药治疗相当,且LV-CCL16与抗PD-1组表现出更强的肿瘤抑制效果。流式结果显示抗PD-1单药治疗对TIME改善有限,而LV-CCL16+抗PD-1组表现出最显著的TIME改善,并达到最大灌注效率。
为评估CCL16在HCC中的临床意义,对正常和HCC肝组织中的蛋白和基因进行检测以及血清中的CCL16进行检测,发现HCC组CCL16的蛋白和mRNA水平明显下降且血清CCL16浓度显著降低。对HCC患者的Kaplan-Meier生存分析显示,高CCL16表达与改善的总生存期相关。TIMER数据库的补充分析表明,同时具有高CCL16表达和巨噬细胞富集的HCC患者生存期最长。综上所述,CCL16驱动的肿瘤TVN与PD-1阻断的协同联合,代表了一种变革性策略,可增强HCC免疫治疗效果,为解决晚期HCC治疗耐药的临床挑战提供了新方向。
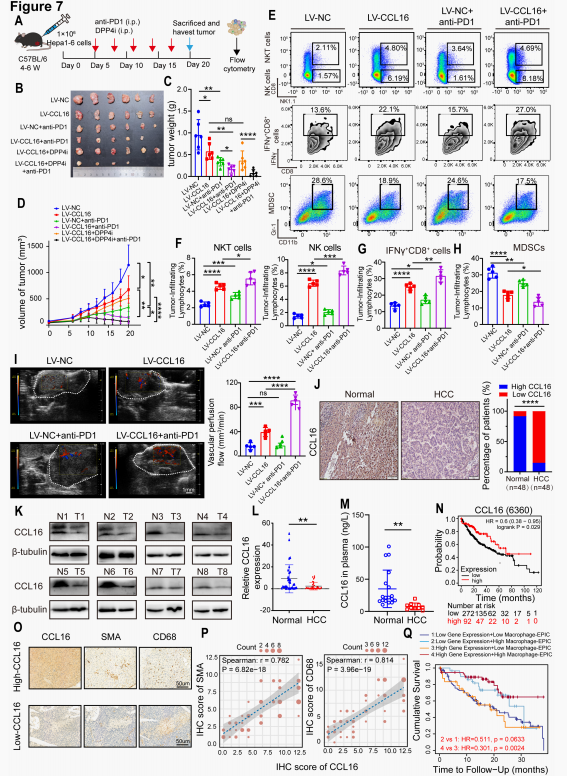
图7. CCL16在HCC中的临床意义及联合治疗策略探索
(图片源于《Cancer Research》)
云克隆开发了涉及上述研究相关靶标的蛋白、抗体以及试剂盒产品,靶标及核心货号如下,供参考:
靶标 | 核心货号 | 靶标 | 核心货号 | 靶标 | 核心货号 |
CD45 | B030 | CD3e | D117 | CD4 | B167 |
CD8a | B099 | VEGF-A | A143 | CD11b | B685 |
F4/80 | K446 | CD31 | A363 | FOXP3 | B877 |
IFNg | A049 | CCL16 | B126 | ICAM1 | A548 |
JAK2 | F494 | STAT6 | B737 | DPP4 | A884 |
IL24 | C064 | CCR1 | B534 | CD31 | A363 |