食物过敏到无过敏反应的“一键切换”
食物过敏的患病率日益增长,其发生是由于过敏原暴露时,产生的食物特异性IgE抗体与肥大细胞表面的受体结合,使机体进入致敏状态。但特定人群即使有食物特异性IgE却对该食物无过敏反应,被认为是“致敏耐受”。目前机制尚不清楚。
2025年8月7日,有研究团队在《Science》期刊上发表了题为“Cysteinyl leukotrienes stimulate gut absorption of food allergens to promote anaphylaxis in mice”的文章,研究了不同过敏反应敏感度的小鼠品系在口服过敏原后的表现。结果显示,小鼠致敏耐受与Dipeptidase 1 (Dpep1)基因变异存在关联。DPEP1可分解白三烯D4(LTD4)。实验表明:使用西司他丁(Cilastatin)阻断DPEP1活性、敲除Dpep1基因或口服LTD4后,抗敏小鼠的过敏原转运能力得到增强。而对易感小鼠预先使用齐留通(Zileuton,可抑制LTD4合成)处理,则能完全阻断过敏原吸收和口服过敏反应。

由于食物过敏是环境和遗传因素相互作用导致的,要找出调控过敏反应的单一因素具有挑战性。实验主要使用了2个遗传组成明确的近交系小鼠模型,C57BL/6品系仅在全身性而非口服方式接触食物过敏原时才会出现过敏反应,属抗性品系;而C3H/HeJ品系作为易感品系,是研究食物过敏的首选品系之一。
为验证口服过敏反应耐受性是否特异于C57BL/6小鼠,研究者首先将多个近交系小鼠同笼饲养两周以消除笼具与品系间的环境差异,连续6周用花生和霍乱毒素(PN+CT)口服灌胃致敏小鼠。致敏一周后,小鼠禁食4小时后通过口服灌胃给予粗花生提取物(CPE)诱发过敏反应。实验结果证实了只有C57BL/6小鼠在口服花生激发试验后未发生过敏反应。但所有实验小鼠品系的血清抗花生蛋白IgE水平均相当。后通过腹腔注射花生提取物对小鼠进行全身性致敏。所有品系的小鼠均表现出严重的过敏反应。后在实验小鼠经过6周致敏处理后,分别接受口服和腹腔注射花生刺激。发现腹腔注射后,C57BL/6和C3H/HeJ小鼠血清中的Ara h 2(花生中的主要致敏蛋白)水平均显著升高;而口服刺激后,C57BL/6小鼠的血清Ara h 2水平相较于C3H/HeJ小鼠明显偏低。有研究表明,食物特异性抗体和过敏性炎症会增加肠道对过敏原的吸收。为此,研究者检测了未致敏的小鼠在稳态下对OVA的吸收差异。结果显示,未致敏的C57BL/6小鼠肠道对OVA的吸收量比C3H/ HeJ小鼠低100多倍。(见图1)
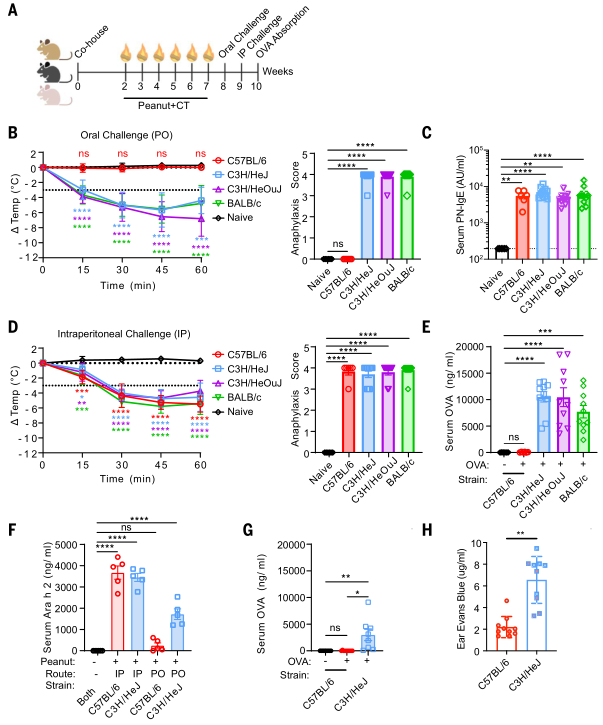
图1. C57BL/6小鼠口服花生未发生过敏反应,与胃肠道抗原吸收减少相关
(图片来源于《Science》杂志)
后研究者将C57BL/6小鼠与C3H/HeJ小鼠杂交培育出N1代小鼠,通过PN+CT致敏N1代小鼠6周后,口服CPE。结果整个N1代小鼠对过敏反应均保持抗性。又将抗性N1代小鼠与C3H/HeJ小鼠回交,在PN+CT致敏6周后检测口服过敏反应易感性。发现N2代中约有50%存在易感性。将对口服过敏反应具有抵抗力的N2代小鼠与C3H/HeJ杂交,低温试验、过敏反应评分和血清肥大细胞蛋白酶(Mast Cell Protease)mMCP-1水平检测显示约有50%(15只中有9只)的N3代小鼠表现出口服过敏耐受性。过敏易感性与血清花生IgE水平无显著相关性。对口服过敏易感的N3代小鼠OVA肠道吸收率高于N1代和口服过敏耐受N3代小鼠。这些结果表明,对口服激发过敏的耐受性及肠道低过敏原摄取能力均为常染色体显性遗传。(见图2)
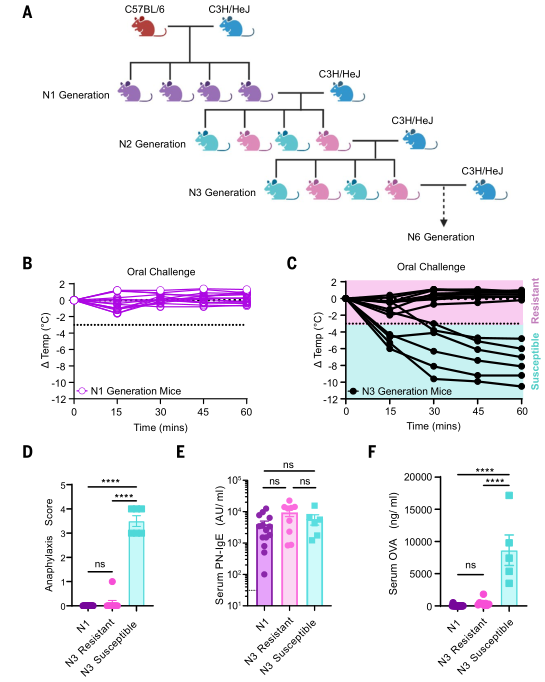
图2. 抵抗口服过敏反应是一种常染色体显性性状,与降低肠道对抗原的渗透性相关
(图片来源于《Science》杂志)
为探究非造血细胞或造血细胞是否促进形成对过敏原具有屏障作用的肠道环境,将C57BL/6小鼠或C3H/HeJ小鼠的骨髓移植到经口致敏诱导处理的抗过敏N1代小鼠体内。所有N1代小鼠在口服花生激发试验中均无过敏反应,尽管它们体内产生了花生IgE抗体。所有品系的小鼠在腹腔注射中均产生过敏反应。且移植后的N1代小鼠肠道对OVA的吸收水平始终维持在较低水平,与未移植的N1代小鼠和C57BL/6小鼠相当。这表明非造血细胞(很可能为肠道上皮细胞)中存在常染色体显性遗传基因,可阻止肠道对过敏原的吸收及随后发生的口服过敏反应。通过比对基因组序列、对C57BL/6和C3H/HeJ小鼠空肠组织进行RNA测序、分析公开的人类和小鼠肠道单细胞RNA测序数据等,研究者发现除管家基因外,候选基因列表中小鼠和人类肠道上皮细胞中Dpep1的表达量最高。Dpep1基因编码的酶能将LTD4分解为LTE4,而LTD4是由LTC4通过GGT酶(gamma-glutamyl transpeptidase,γ-谷酰胺转酞酶)转化而来,LTC4、LTD4和LTE4都属于CysLT(Cysteinyl Leukotriene,半胱氨酰白三烯)。实验后发现,未致敏的C57BL/6小鼠空肠裂解液中的DPEP1酶活性更高。免疫荧光检测显示,C57BL/6和C3H/HeJ小鼠的空肠微绒毛膜均存在DPEP1染色,但仅在C57BL/6小鼠空肠组织的固有层中检测到DPEP1蛋白,而C57BL/6 Dpep11−/−小鼠则未见染色。后实验验证,无论是通过基因改造(Dpep11−/−小鼠)还是药物抑制(西司他丁)手段降低DPEP1酶活性,都会导致肠道对抗原的吸收增强并引发过敏反应。(见图3)
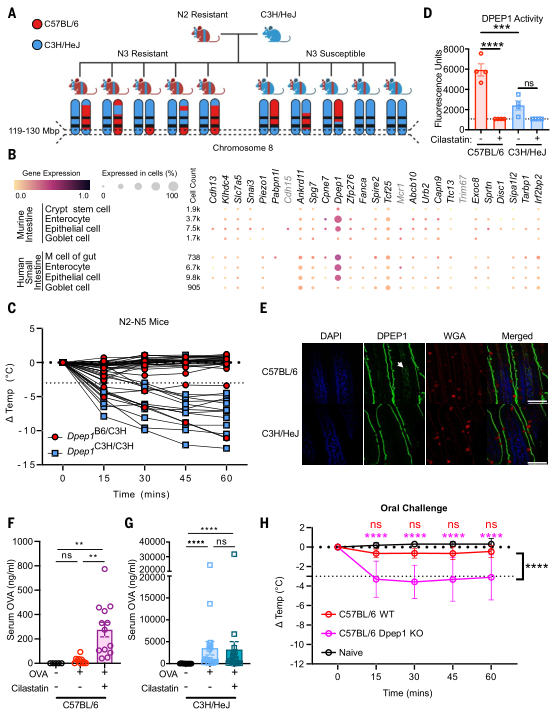
图3. Dpep1基因与口服过敏反应耐受性相关
(图片来源于《Science》杂志)
研究者通过液相色谱-串联质谱检测发现与C3H/HeJ小鼠相比,C57BL/6小鼠空肠中的LTC4和LTD4均减少。后让小鼠口服OVA和LTD4,发现LTD4增强了C57BL/6和C3H/HeJ小鼠的OVA吸收。LTE4比LTC4或LTD4更稳定,但LTE4并未增加两种品系小鼠对OVA的吸收率。将花生与LTD4混合后,经口服对过敏致敏的C57BL/6小鼠进行刺激。为排除LTD4本身对过敏反应的影响,另一组过敏致敏的小鼠仅口服LTD4而未添加过敏原。实验数据显示,只有同时接触花生和LTD4的C57BL/6小鼠出现过敏反应。通过灌胃法让未经免疫的C57BL/6小鼠摄入OVA-AF647与LTD4的混合液。结果显示,与对照组组相比,联合处理的小鼠空肠绒毛固有层中显现出更显著的OVA-AF647荧光信号。这一现象表明,CysLTs能快速诱导完整肠道腔内抗原的摄取。(见图4)
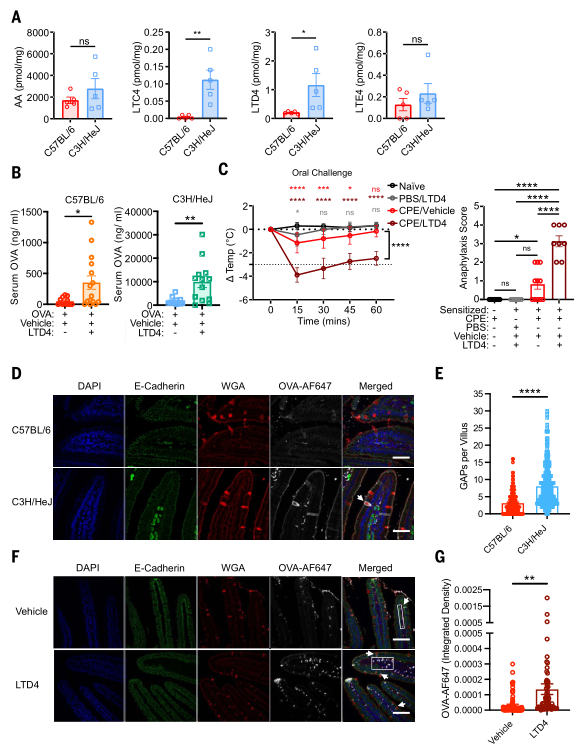
图4. LTD4 介导抗原吸收增强与口服过敏反应易感性
(图片来源于《Science》杂志)
LTC4和LTD4通过两种G蛋白偶联受体——CYSLTR1和CYSLTR2 发挥信号传导作用,而孟鲁司特是美国食品药品监督管理局(FDA)批准的CYSLTR1抑制剂。实验发现孟鲁司特处理并不能降低的C3H/HeJ小鼠对口服激发过敏的的易感性。后研究者使用了FDA批准的药物齐留通来消除所有CysLT的生成,采取口服的方式,结果显示该药物能完全且剂量依赖性地预防核心体温下降及过敏反应临床症状。经齐留通治疗的C3H/HeJ小鼠在口服花生后,血清中的Ara h 2水平显著降低。类似地,对未接触过过敏原的C3H/HeJ小鼠进行单次齐留通给药预处理(暴露前1小时),可显著减少其肠道对OVA的吸收。这表明CysLTs在过敏过程中,能显著增强肠道抗原吸收能力。而让过敏致敏的C3H/HeJ小鼠在腹腔注射花生前1小时接受齐留通预处理。与口服花生致敏不同,齐留通预处理对腹腔致敏小鼠的低体温反应和临床过敏反应评分均无保护作用,证实齐留通对口服过敏反应的影响并非通过抑制症状产生。因此得出结论:CysLTs选择性地促进口服过敏反应的发生。(见图5)
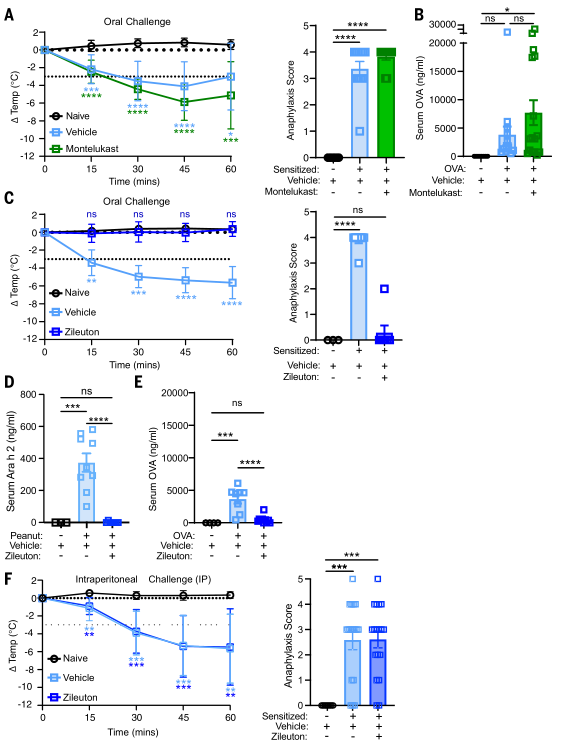
图5. 抑制CysLT的产生会阻断肠道食物抗原吸收和口服过敏反应
(图片来源于《Science》杂志)
基于该研究结果,DPEP1是小鼠肠道过敏原吸收的主要调控因子,与肠道LTC4和LTD4减少,肠道过敏原摄取降低及口服过敏反应抵抗力增强相关。阻断DPEP1后,数小时内即可引发过敏原转运和过敏反应,而单次剂量的齐留通就足以抑制肠道过敏原转运,并在口服食物激发试验后预防过敏性休克。齐留通这种药物可为意外接触过敏原时发生过敏反应的人群提供急性预防疗法。
这篇研究为食物过敏的预防及治疗提供了新的思路。云克隆开发了与该研究相关的靶标产品,部分指标节选如下:
更多信息,欢迎访问:http://www.cloud-clone.cn/