蛋白激酶在神经退行性疾病发病机制中的作用(二)
前面介绍了蛋白激酶在阿尔茨海默病发病机制中的作用,阐述了蛋白激酶抑制剂在阿尔茨海默病临床应用上的进展。这回我们继续介绍帕金森病(PD)与蛋白激酶的关系。

PD的主要临床症状是运动功能障碍,以及非运动性缺陷,包括认知能力下降、抑郁以及疼痛,这些都会极大地影响患者的生活质量。PD病理特征为α-突触核蛋白(α-syn)异常聚集形成路易小体/路易神经突,以及黑质致密部(SNpc)多巴胺能神经元选择性丢失。下文总结了几种关键激酶在PD中的作用。(图 2 )。
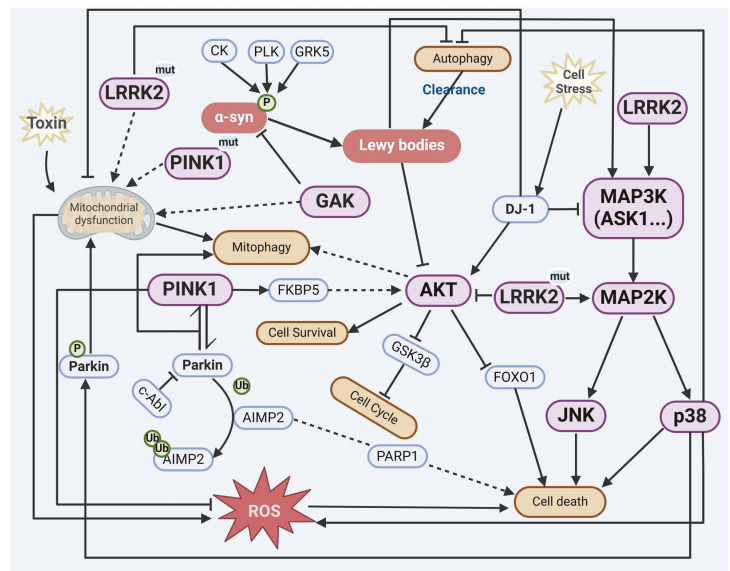
亮氨酸重复激酶2(LRRK2):LRRK2主要存在于细胞质中,调节膜修复与细胞器替换之间的平衡,以维持内质网-溶酶体的稳态,致病性突变会导致膜损伤,进而破坏内质网-溶酶体的稳态。LRRK2基因是家族性PD中最常见的突变基因之一,其突变也存在于散发性PD患者中。在特发性帕金森病(iPD)患者中,SNpc的多巴胺能神经元和小胶质细胞中的LRRK2激酶活性会增加,这表明LRRK2参与了iPD的发病过程。G2019S是PD中最常见的LRRK2突变,占家族性PD病例的4%以及散发性PD病例的1%。这种突变会导致路易小体和神经纤维中的典型α-淀粉样蛋白聚集,以及特定脑区的神经元损失。
丝氨酸/苏氨酸蛋白激酶PINK1,线粒体(PINK1)和E3泛素蛋白连接酶(Parkin):细胞质蛋白Parkin与泛素激酶PINK1协同作用,介导与线粒体相关的自噬过程。PINK1定位于受损线粒体膜,磷酸化泛素(Ser65)并激活Parkin,促进线粒体泛素化标记及后续自噬清除。PINK1和Parkin的突变是常染色体隐性PD的主要原因,这些蛋白质的功能障碍会导致早发性PD。PINK1的G309D和L347P突变会导致其活性显著降低,通过抑制细胞色素c从线粒体释放进而抑制其抗凋亡功能。由于PRKN(编码Parkin)突变,病理性底物(如氨酰-tRNA合成酶复合物相互作用多功能蛋白2(AIMP2))积累随之发生。非受体酪氨酸激酶c-Abl在Tyr143位点磷酸化Parkin,导致其活性降低。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的c-Abl激活会导致Parkin失活,进而引起AIMP2积累和神经元死亡。此外,在PD患者死后脑组织中,c-Abl被激活,Parkin在酪氨酸143位点被磷酸化,因此,c-Abl可能通过抑制Parkin活性在PD中起到致病激酶的作用。
细胞周期蛋白g相关激酶(GAK):是PD易感基因,神经元特异性敲除GAK会导致新生小鼠神经祖细胞增殖缺陷,从而导致细胞损失,说明GAK抑制与神经发育障碍有关。GAK通过改变线粒体网络和溶酶体形态来影响与PRKN无关的线粒体自噬,从而揭示了线粒体自噬的调控机制。在果蝇中,与GAK同源的辅助蛋白的下调会导致果蝇爬行能力下降、寿命缩短以及多巴胺能神经元的损失。体外实验表明,在过表达α-syn的细胞中敲低GAK会增加α-syn的水平,并导致细胞毒性,这表明GAK可能在PD中发挥保护作用。
蛋白激酶B(AKT):通过PI3K/AKT通路调控细胞存活、代谢及线粒体功能,是PD中重要的神经保护信号分子。在PD的体外模型中,1-甲基-4-苯基吡啶离子(MPP+)会抑制AKT的活性。PINK1调节胰岛素依赖型AKT信号通路的激活,可能是通过磷酸化FK506结合蛋白5来实现的,并且能够修复MPP+引起的线粒体复合物I的损伤。MPTP引起的AKT激活抑制可通过Parkin的过表达得到恢复。LRRK2磷酸化AKT并通过抑制叉头框蛋白O1来促进细胞存活。LRRK2的G2019S和R1441C突变会降低AKT的磷酸化水平,而随后通过AKT抑制对细胞存活的促进作用的阻断可能会导致PD中的神经元死亡,因此,恢复AKT的功能并激活AKT信号通路,可能对PD具有保护作用。
c-Jun氨基末端激酶(JNK)和p38蛋白:在MPTP引发的PD模型中,JNK2和JNK3诱导环氧合酶2表达上调,激活由c-Jun引起的多巴胺能神经元的死亡过程。在α-syn转基因小鼠中,p38 MAPK活性增加会导致Parkin的直接磷酸化以及随后的线粒体功能障碍。α-syn会激活依赖于Toll样受体4的p38 MAPK并导致小胶质细胞自噬功能障碍以及神经炎症的诱导。JNK和p38 MAPK可以通过LRRK2经由MAP2K间接发生磷酸化,这可能是因为LRRK2激酶结构域与MAP3K家族成员具有高度同源性。此外,与PD相关的LRRK2-G2019S突变已被发现对MAP2K的磷酸转移酶活性有增强作用。
凋亡信号调节激酶1(ASK1):ASK1是MAP3K家族的一员,它能够对MAP2K进行磷酸化并激活其后续的MAPK,从而放大下游信号传导级联反应。ASK1本身也参与生理过程以及细胞死亡过程,通过调节JNK和p38的激活。在MPTP模型中,ASK1-MAPK可能是由于TNF依赖性的硫氧还蛋白1氧化而被激活的。并且,敲除ASK1可以挽救MPTP引起的运动障碍、多巴胺能神经元损失以及神经炎症。ASK1抑制剂JNK3-N-Tat可以减轻MPP+处理的原代皮质细胞以及MPTP小鼠模型中的线粒体损伤,并抑制多巴胺能神经元的凋亡。此外,Apelin-36这种神经调节肽通过抑制ASK1/JNK/caspase-3通路保护MPTP小鼠模型中的神经元免受凋亡。ASK1的激活现象也出现在α-淀粉样蛋白过度表达的细胞以及转基因动物模型中,这表明ASK1参与了α-淀粉样蛋白的级联效应。通过删除ASK1 能够缓解纹状体内已形成的α-淀粉样蛋白以及磷酸化α-淀粉样蛋白的积累所引起的行为缺陷。ASK1还在被LRRK2作用于Thr832后激活细胞死亡相关通路,而且DJ-1无法激活ASK1的作用则显示出在氧化应激诱导的细胞死亡中具有保护作用。
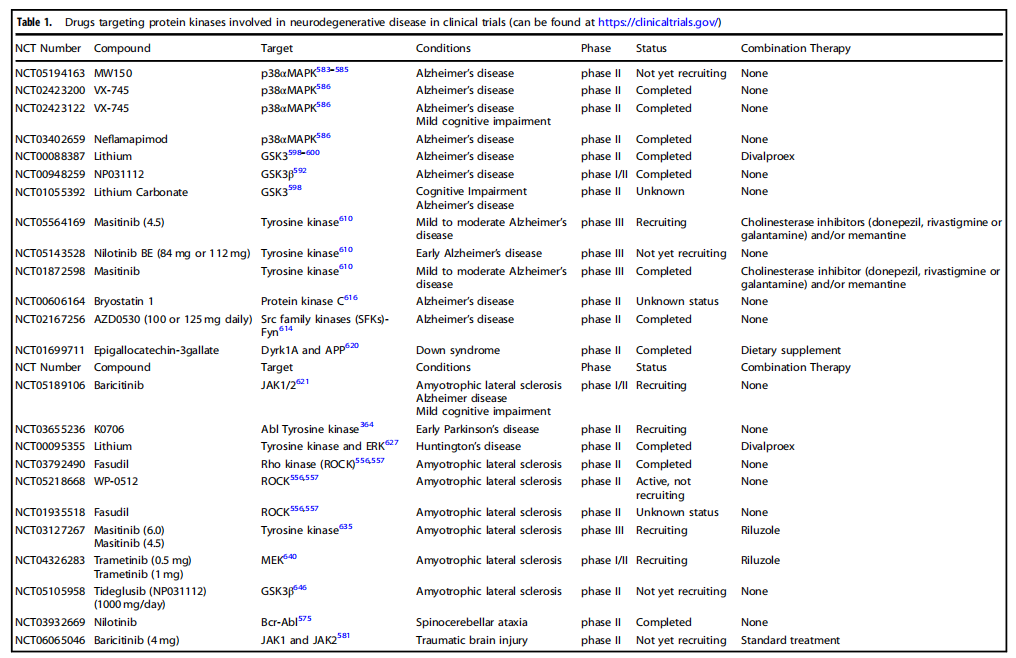
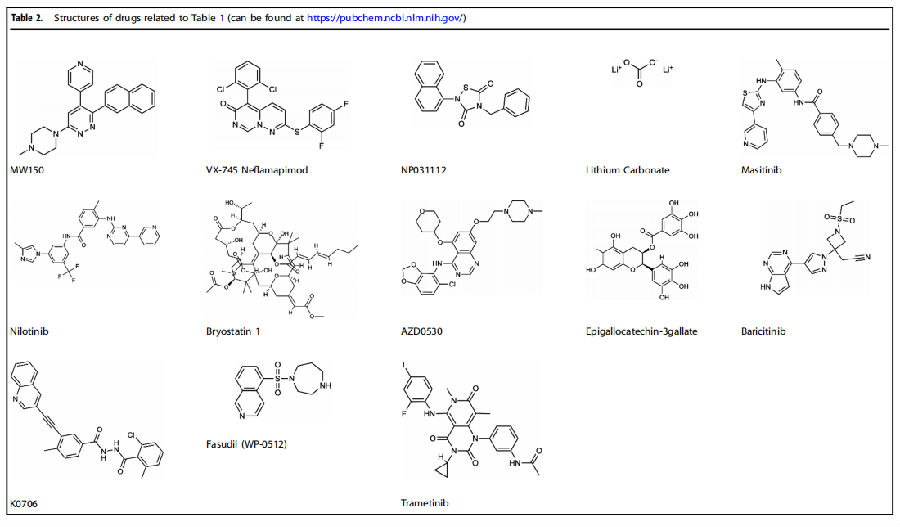
目前针对PD靶向蛋白激酶的药物有:
LRRK2抑制剂:抑制LRRK2异常升高的激酶活性,恢复溶酶体功能与线粒体稳态。FL090:通过上调微管相关蛋白1B(MAP1B)改善溶酶体功能,在 PD动物模型中减少黑质多巴胺能神经元丢失;WXWH0226、ARV-102以及DNL201/DNL151:均进入临床 I/II 期,其中DNL151显示良好的血脑屏障穿透性,可降低脑脊液中α-syn水平;反义寡核苷酸(ASOs):通过下调LRRK2表达,在PD小鼠模型中减少α-syn包涵体形成,处于临床前验证阶段。
c-Abl抑制剂:抑制c-Abl对Parkin的磷酸化,恢复其线粒体自噬功能,减少AIMP2积累。K0706:高选择性c-Abl抑制剂,血脑屏障穿透性优于传统抑制剂(如尼洛替尼),在健康志愿者与PD患者中显示良好耐受性,可显著抑制脑内c-Abl活性,目前处于II期临床(NCT03655236);尼洛替尼:广谱酪氨酸激酶抑制剂,在PD临床中因血脑屏障穿透率低(最大剂量下效果有限),仅轻微改善运动症状,暂未达到临床终点。
ASK1抑制剂:抑制ASK1介导的JNK/p38激活,减轻氧化应激与神经炎症。Selonsertib(GS-4997):已在糖尿病肾病中验证安全性,在PD细胞模型中可抑制α-syn诱导的神经元凋亡,但尚未进入PD临床;JNK3-N-Tat:肽类抑制剂,在MPTP小鼠模型中减轻线粒体损伤,抑制多巴胺能神经元凋亡,处于临床前阶段。
ROCK抑制剂(如法舒地尔,Fasudil):通过激活AKT、抑制小胶质细胞炎症(减少TNF-α/IL-6释放),在SOD1-G93A PD模型中改善运动功能,目前在PD中的临床探索仍在早期;
p38 MAPK抑制剂(如SB203580):在PD动物模型中可减少α-syn诱导的神经炎症,但因靶点选择性差(抑制所有p38亚型),未进入临床。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关研究,部分指标节选如下,供参考。
指标名 | 核心货号 | 指标名 | 核心货号 |
LRRK2 | H716 | PINK1 | L057 |
AKT | C231 | JNK2 | D576 |
ASK1 | B358 | PRKN | L060 |
ERK1 | B357 | ERK2 | A930 |
PI3K | J829 | FKBP5 | E645 |
PARP1 | A279 | FOXO1 | A764 |