细胞内的“哨兵系统”:解码NOD样受体如何调控健康与疾病
细胞内的“哨兵系统”:解码NOD样受体如何调控健康与疾病
1. NOD样受体家族简介
NOD样受体(NLR)蛋白家族是一组模式识别受体(PRR),因其在维持组织稳态和通过检测病原体相关分子模式(PAMP)和损伤相关分子模式(DAMP)抵御细菌、病毒和真菌的感染方面的核心作用而广受关注。
1.1 NLR家族结构
NLR蛋白家族的成员具有许多共同的结构特征。它们都具有参与配体识别的C端亮氨酸重复序列(LRR)结构域、促进自寡聚化和三磷酸腺苷依赖性激活的中心核苷酸结合寡聚化结构域(NACHT),以及可变的N端效应结构域,该结构域与接头分子和下游效应子结合以介导信号转导。N端效应结构域是NLRs中最显著的组成部分,它与各种接头分子和下游效应子结合以介导信号转导,根据独特的功能特征可分为五个亚家族:NLRA、NLRB、NLRC、NLRP和NLRX1。

图1 NLR家族中各成员的蛋白质结构示意图
(图片源于《Int J Mol Sci》[1])
1.2 NLR家族功能
NLRs分布在胞质溶胶中,可识别来自微生物病原体(肽聚糖、鞭毛蛋白、病毒RNA、真菌菌丝等)、宿主细胞(ATP、胆固醇晶体、尿酸等)和环境来源(明矾、石棉、二氧化硅、合金颗粒、紫外线辐射、皮肤刺激物等)的各种配体。大多数NLRs充当PRRs,识别上述配体并激活炎症反应。然而,一些NLRs可能不充当PRRs,而是对干扰素等细胞因子做出反应。激活的NLRs表现出各种功能,可分为四大类:炎症小体形成、信号转导、转录激活和自噬。
1.3 NLR信号传导途径
NLR家族的信号机制相对保守。在NLRs与配体特异性结合后,NACHT结构域自寡聚化,随后发生半胱天冬酶募集结构域(CARD)-CARD相互作用。然后,寡聚化NLRs蛋白与丝氨酸/苏氨酸受体相互作用蛋白2激酶(RIPK2)相互作用。RIPK2通过IKK和转化生长因子β活化激酶1(TAK1)诱导NF-κB和MAPK信号通路的激活,从而促进促炎基因的转录。此外,多种信号通路,包括NOD1/TNF受体相关因子3(TRAF3)通路、NOD2/线粒体抗病毒信号传导(MAVS)蛋白通路和NOD蛋白/自噬相关蛋白(ATG)通路,可促进宿主防御和自噬降解。
1.4 NLRP3炎性小体
炎性小体是一种寡聚蛋白复合物,由三部分组成:NLR分子、效应分子和偶联分子。在NLR家族中,有几个成员参与炎性小体的形成,包括NLRP1、NLRP2、NLRP3、NLRP6、NLRP7、NLRP12、NLRC4和NAIP。NLRP3炎性小体是近年来研究最广泛的炎性小体之一。响应于PAMP/DAMP,二聚化的NLRP3分子聚合两个PYD效应结构域,激活含有CARD的细胞死亡相关斑点样蛋白,并通过募集pro-caspase-1促进caspase-1的自催化激活。Caspase-1将两种非活性细胞因子前体(pro-IL-1β和pro-IL-18)分别切割成活性IL-1β和IL-18。在某些情况下,caspase-1还可以裂解gasdermin D,产生N末端切割产物,引发一种称为细胞焦亡的特定类型的炎症性死亡。
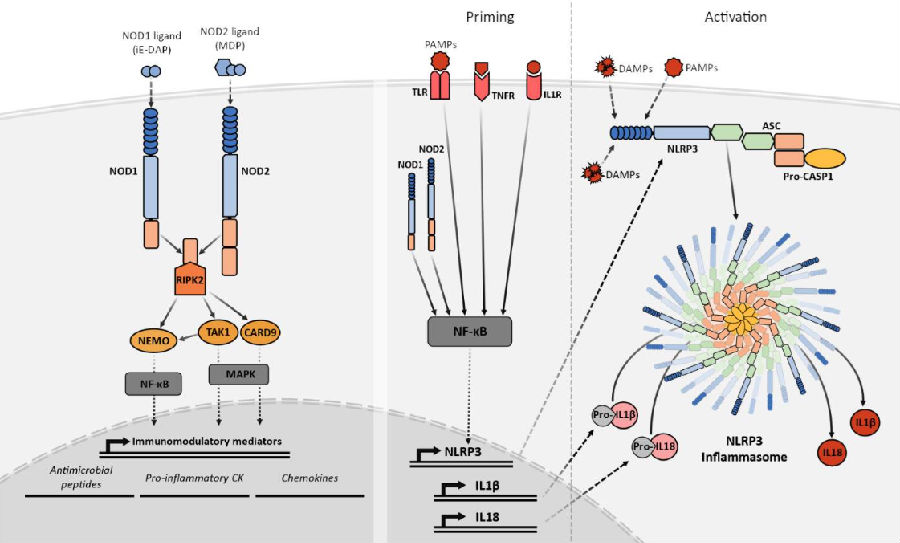
图2 NOD1、NOD2和NLRP3信号通路的简化表示
(图片源于《Front Immunol》[2])
2. NLR家族与癌症的相关研究
NLR家族作为先天免疫系统中的重要PRR,在癌症研究中备受关注。产肠毒素脆弱拟杆菌(ETBF)通过分泌与NOD1结合的BFT-1促进乳腺癌细胞的干性和化疗耐药性[3]。抑制NOD1通过靶向乳腺癌干细胞增加乳腺癌的化学敏感性。转录因子HOXC10激活NOD1/ERK信号通路,重新编程上皮间质转化和骨微环境,促进KRAS突变肺癌骨转移[4]。BMI1原癌基因诱导NLRC5的泛素化和蛋白质降解,并抑制HLA I类表达,这可能有助于非小细胞肺癌(NSCLC)的免疫逃逸[5]。药物激活NLRC5可增加HLA I类的表达,可有效治疗乳腺癌[6]。Nlrp12缺陷小鼠容易诱发结肠炎症和肿瘤,这与炎症细胞因子、趋化因子和致瘤因子的产生增加有关[7]。雌激素受体可以通过靶向NLRs来调节癌症中的Wnt/β-catenin信号通路[8]。NLRP1表达减少会导致癌症进展,其异常表达与对多种抗肿瘤药物和小化合物的敏感性降低有关[9]。高NLRP1/NLRP3表达会促进免疫细胞浸润和胃癌预后不良[10]。NLR家族在肿瘤微环境中的双重作用,使其成为癌症免疫治疗和生物标志物开发的潜在靶点。

图3 BMI1与NLRC5结合促进NSCLC的免疫逃逸
(图片源于《Kaohsiung J Med Sci》[5])
3. NLR家族与自身免疫疾病的相关研究
越来越多的证据表明,NLRs参与了多种自身免疫性疾病的发生和发展。细菌暴露可能会增加系统性红斑狼疮(SLE)免疫抑制剂初治患者单核细胞中NOD2的表达,从而导致PBMC的异常激活和促炎细胞因子的产生,可能加剧SLE[11]。SLE患者PBMC中NLRP12表达水平较低,与IFNA表达和疾病活动性呈负相关[12]。NLRP3多态性与SLE疾病活动度增加和血清生物标志物(C4、IL-1β和IFN-γ)表达相关[13]。在咪喹莫特诱导的银屑病样小鼠模型中,GSDMD敲低抑制NLR通路,并伴有NLRP3、NOD1、NOD2和PYCARD蛋白水平降低,改善了皮肤病变的严重程度,减轻了红斑、表皮厚度和炎症细胞浸润[14]。NB-UVB光疗有效调节NOD2表达,改善银屑病患者的临床和组织病理结局[15]。中枢神经系统中的肽聚糖通过NOD1、NOD2和RIP2介导的途径激活浸润的树突状细胞,参与实验性自身免疫性脑脊髓炎(多发性硬化症模型)的发病机制[16]。这些发现提示NLRs抑制剂可能有助于自身免疫疾病的治疗。
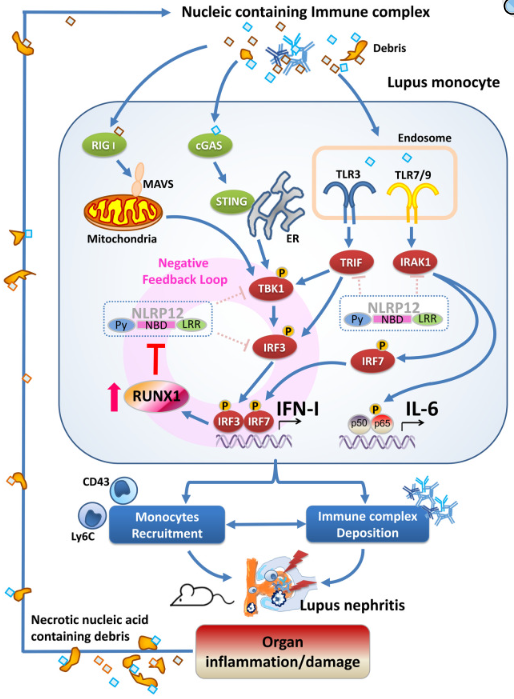
图4 NLRP12可抑制IFN并减缓狼疮肾炎进展
(图片源于《J Clin Invest》[12])
4. NLR家族与肠道疾病的相关研究
近年来,多项研究揭示了NLRs在肠道炎症性疾病中的显著影响。NOD2的功能丧失突变与人类克罗恩病(CD)密切相关[17]。NOD2-/-小鼠对2,4,6-三硝基苯磺酸诱发结肠炎的易感性增加[18]。NOD2信号通过识别肠道微生物群和促进IL-15产生维持肠道上皮内淋巴细胞数量并调控CD易感性。NOD2在调控Paneth细胞介导的肠道细菌反应中发挥作用,NOD2突变导致CD患者感知腔内细菌的能力受损,对某些肠道微生物的易感性增加[19]。NLRP3显性功能获得错义变体R779C增加了巨噬细胞NLRP3炎症小体的活化和焦亡,在葡聚糖硫酸钠(DSS)诱导的急性结肠炎模型中,造血细胞中的NLRP3-R779C导致更严重的结肠炎[20]。NLRP6炎症小体缺乏的小鼠表现为自发性肠道增生、炎症性细胞招募以及DSS引发的结肠炎加重[21]。缺乏Nlrp12的小鼠对结肠炎症的发生高度敏感,这与炎症性细胞因子和趋化因子的产生增加相关,提示NLRP12在维持肠道稳态的关键作用[22]。这些研究表明阐明NLR信号通路的分子机制可能为开发肠道疾病相关的治疗策略提供新机遇。

图5 NLRP6炎症小体调节结肠微生物生态及结肠炎风险
(图片源于《Cell》[21])
5. NLR家族与炎症性关节炎的相关研究
越来越多的研究表明,NLRs在驱动炎症性关节炎发病机制中的作用。痛风性关节炎中尿酸钠(MSU)晶体激活关节内的先天细胞,触发NLRP3炎症小体组装并释放成熟IL-1β,引发急性炎症,并导致关节肿胀和剧烈疼痛[23]。NLRP3炎症小体抑制剂可降低滑膜IL-1β和IL-6水平,限制MSU晶体诱导的关节炎[24]。NLRC5可能通过NF-κB信号通路促进成纤维细胞样滑膜细胞(FLS)增殖和炎症性细胞因子分泌,进而促进类风湿关节炎(RA)的进展[25]。NLRP6在RA-FLS中表达较低,与TRIM38和TAB2/3之间的相互作用减弱有关,导致NF-κB的持续激活,产生促炎细胞因子,最终引发滑膜组织的炎症[26]。在抗原诱导关节炎模型中,Nlrp12-/-小鼠会出现严重关节炎,表现为Th17介导的炎症反应加剧,伴有关节痛觉敏感、膝关节肿胀和中性粒细胞浸润增加[27]。NOD-1在RA患者滑膜组织的不同细胞类型中强烈表达,在RA慢性且破坏性炎症中发挥重要作用[28]。因此,靶向NLRs及相关炎症小体可能是炎症性关节炎的潜在治疗方式。
6. NLR家族与神经退行性疾病的相关研究
研究表明NLR家族与神经退行性疾病的病理生理有关。在1-甲基-4-苯基-1,2,3,6-四氢吡啶盐酸盐(MPTP)诱导的帕金森病(PD)小鼠中,黑质纹状体轴的NLRC5表达增加[29]。NLRC5缺乏显著减少MPTP诱导的PD模型中多巴胺(DA)系统退化,并改善了运动功能障碍和纹状体炎症。Parkin蛋白通过泛素化并靶向降解NLRP3,抑制炎症小体形成,防止PD模型中DA神经元的退化[30]。在阿尔茨海默病(AD)中,NLRP3的功能丧失促进了谷氨酰胺和谷氨酸相关代谢,并增加了小胶质细胞Slc1a3的表达,增强代谢活动并提高Aβ肽的清除率[31]。敲低转基因AD模型小鼠大脑中的NLRP1显著减少神经元焦亡,逆转了认知障碍[32]。释放到细胞质中的Aβ诱导的组织蛋白酶降解NLRP10,使NLRP3解离并形成炎症小体;用重组NLRP10处理胶质细胞培养物能减少Aβ诱导caspase 1激活和IL-1β的释放[33]。这些结果可能为神经退行性疾病新治疗策略的开发提供帮助。

图6 NLRC5调节神经炎症和神经元存活
(图片源于《J Neuroinflammation》[29])
云克隆助力科学研究,为广大科研人员提供相关检测试剂产品,相关靶标核心货号如下:
靶标 | 核心货号 | 靶标 | 核心货号 | 靶标 | 核心货号 |
BIRC2 | E231 | IL8 | A080 | MAPK14 | B206 |
BIRC3 | E232 | IRAK1 | B514 | NAIP | B524 |
CARD9 | P108 | IRAK2 | B515 | NFkB | B824 |
CASP1 | B592 | IRAK3 | B520 | NFkB2 | B825 |
c-Jun | B292 | IRAK4 | B518 | NFKB3 | A616 |
ERK1 | B357 | IRF3 | B589 | NLRC4 | L954 |
ERK2 | A930 | IRF8 | B776 | NLRC5 | M895 |
IFNa | A033 | JNK1 | B156 | NLRP1 | K117 |
IFNb | A222 | JNK2 | D576 | NLRP3 | K115 |
IkBa | B848 | JunB | H765 | NLRP7 | N497 |
IkBb | B849 | MAP2K3 | D563 | NOD1 | K296 |
IkBe | E700 | MAP2K4 | D564 | NOD2 | K295 |
IkBKb | J822 | MAP2K6 | B721 | PYCARD | M075 |
IkBKg | J820 | MAP2K7 | D560 | RelB | B826 |
IKKA | K407 | MAPK11 | B435 | TAB1 | L705 |
IL18 | A064 | MAPK12 | D577 | TAK1 | D567 |
IL1b | A563 | MAPK13 | D578 | TNFa | A133 |
IL6 | A079 |
更多科研试剂,欢迎访问云克隆官方网站:http://www.cloud-clone.cn/
参考文献
[1]Zhou Y, Yu S, Zhang W. NOD-like Receptor Signaling Pathway in Gastrointestinal Inflammatory Diseases and Cancers. Int J Mol Sci. 2023;24(19):14511.
[2]Alvarez-Simon D, Ait Yahia S, de Nadai P, et al. NOD-like receptors in asthma. Front Immunol. 2022;13:928886.
[3]Ma W, Zhang L, Chen W, et al. Microbiota enterotoxigenic Bacteroides fragilis-secreted BFT-1 promotes breast cancer cell stemness and chemoresistance through its functional receptor NOD1. Protein Cell. 2024;15(6):419-440.
[4]Li K, Yang B, Du Y, et al. The HOXC10/NOD1/ERK axis drives osteolytic bone metastasis of pan-KRAS-mutant lung cancer. Bone Res. 2024;12(1):47.
[5]Lu ZH, Tu GJ, Fu SL, et al. BMI1 induces ubiquitination and protein degradation of Nod-like receptor family CARD domain containing 5 and suppresses human leukocyte antigen class I expression to induce immune escape in non-small cell lung cancer. Kaohsiung J Med Sci. 2022;38(12):1190-1202.
[6]Wada A, Hirohashi Y, Kutomi G, et al. Eribulin is an immune potentiator in breast cancer that upregulates human leukocyte antigen class I expression via the induction of NOD-like receptor family CARD domain-containing 5. Cancer Sci. 2023;114(12):4511-4520.
[7]Zaki MH, Vogel P, Malireddi RK, et al. The NOD-like receptor NLRP12 attenuates colon inflammation and tumorigenesis. Cancer Cell. 2011;20(5):649-660.
[8]Liu S, Fan W, Gao X, et al. Estrogen receptor alpha regulates the Wnt/β-catenin signaling pathway in colon cancer by targeting the NOD-like receptors. Cell Signal. 2019;61:86-92.
[9]Habibipour L, Sadeghi M, Raghibi A, Sanadgol N, Mohajeri Khorasani A, Mousavi P. The NLRP1 Emerges as a Promising Therapeutic Target and Prognostic Biomarker Across Multiple Cancer Types: A Comprehensive Pan-Cancer Analysis. Cancer Med. 2025;14(8):e70836.
[10]Wang P, Gu Y, Yang J, et al. The prognostic value of NLRP1/NLRP3 and its relationship with immune infiltration in human gastric cancer. Aging (Albany NY). 2022;14(24):9980-10008.
[11]Yu SL, Wong CK, Wong PT, et al. Down-regulated NOD2 by immunosuppressants in peripheral blood cells in patients with SLE reduces the muramyl dipeptide-induced IL-10 production. PLoS One. 2011;6(8):e23855.
[12]Tsao YP, Tseng FY, Chao CW, et al. NLRP12 is an innate immune checkpoint for repressing IFN signatures and attenuating lupus nephritis progression. J Clin Invest. 2023;133(3):e157272.
[13]Su Z, Niu Q, Huang Z, Yang B, Zhang J. Association of nucleotide-binding oligomerization domain-like receptor family pyrin domain-containing protein 3 polymorphisms with systemic lupus erythematosus disease activity and biomarker levels: A case-control study in Chinese population. Medicine (Baltimore). 2020;99(35):e21888.
[14]Lai S, Chen H, Ji X, et al. Knockdown of GSDMD inhibits pyroptosis in psoriasis by blocking the NOD-like receptor signaling pathway. Int Immunopharmacol. 2025;147:114036.
[15]Sarsik S, Far NNE, Mohamed DA, Nassar SO. NOD2 expression in psoriasis before and after treatment with Narrowband Ultraviolet B phototherapy. Arch Dermatol Res. 2025;317(1):260.
[16]Shaw PJ, Barr MJ, Lukens JR, et al. Signaling via the RIP2 adaptor protein in central nervous system-infiltrating dendritic cells promotes inflammation and autoimmunity. Immunity. 2011;34(1):75-84.
[17]Hampe J, Cuthbert A, Croucher PJ, et al. Association between insertion mutation in NOD2 gene and Crohn's disease in German and British populations. Lancet. 2001;357(9272):1925-1928.
[18]Jiang W, Wang X, Zeng B, et al. Recognition of gut microbiota by NOD2 is essential for the homeostasis of intestinal intraepithelial lymphocytes. J Exp Med. 2013;210(11):2465-2476.
[19]Ogura Y, Lala S, Xin W, et al. Expression of NOD2 in Paneth cells: a possible link to Crohn's ileitis. Gut. 2003;52(11):1591-1597.
[20]Zhou L, Liu T, Huang B, et al. Excessive deubiquitination of NLRP3-R779C variant contributes to very-early-onset inflammatory bowel disease development. J Allergy Clin Immunol. 2021;147(1):267-279.
[21]Elinav E, Strowig T, Kau AL, et al. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis. Cell. 2011;145(5):745-757.
[22]Zaki MH, Vogel P, Malireddi RK, et al. The NOD-like receptor NLRP12 attenuates colon inflammation and tumorigenesis. Cancer Cell. 2011;20(5):649-660.
[23]So AK, Martinon F. Inflammation in gout: mechanisms and therapeutic targets. Nat Rev Rheumatol. 2017;13(11):639-647.
[24]Marchetti C, Swartzwelter B, Koenders MI, et al. NLRP3 inflammasome inhibitor OLT1177 suppresses joint inflammation in murine models of acute arthritis. Arthritis Res Ther. 2018;20(1):169.
[25]Liu YR, Yan X, Yu HX, et al. NLRC5 promotes cell proliferation via regulating the NF-κB signaling pathway in Rheumatoid arthritis. Mol Immunol. 2017;91:24-34.
[26]Lin Y, Luo Z. NLRP6 facilitates the interaction between TAB2/3 and TRIM38 in rheumatoid arthritis fibroblast-like synoviocytes. FEBS Lett. 2017;591(8):1141-1149.
[27]Prado DS, Veras FP, Ferreira RG, et al. NLRP12 controls arthritis severity by acting as a checkpoint inhibitor of Th17 cell differentiation. FASEB J. 2020;34(8):10907-10919.
[28]Yokota K, Miyazaki T, Hemmatazad H, et al. The pattern-recognition receptor nucleotide-binding oligomerization domain--containing protein 1 promotes production of inflammatory mediators in rheumatoid arthritis synovial fibroblasts. Arthritis Rheum. 2012;64(5):1329-1337.
[29]Liu Z, Shen C, Li H, et al. NOD-like receptor NLRC5 promotes neuroinflammation and inhibits neuronal survival in Parkinson's disease models. J Neuroinflammation. 2023;20(1):96.
[30]Panicker N, Kam TI, Wang H, et al. Neuronal NLRP3 is a parkin substrate that drives neurodegeneration in Parkinson's disease. Neuron. 2022;110(15):2422-2437.e9.
[31]McManus RM, Komes MP, Griep A, et al. NLRP3-mediated glutaminolysis controls microglial phagocytosis to promote Alzheimer's disease progression. Immunity. 2025;58(2):326-343.e11.
[32]Tan MS, Tan L, Jiang T, et al. Amyloid-β induces NLRP1-dependent neuronal pyroptosis in models of Alzheimer's disease. Cell Death Dis. 2014;5(8):e1382.
[33]Murphy N, Grehan B, Lynch MA. Glial uptake of amyloid beta induces NLRP3 inflammasome formation via cathepsin-dependent degradation of NLRP10. Neuromolecular Med. 2014;16(1):205-215.