Nature揭秘:母乳喂养可降低三阴性乳腺癌风险
人们普遍认为,生育和哺乳能够降低乳腺癌的长期风险。目前学术界认为,生育通过重塑妊娠期、哺乳期及复旧期乳腺上皮细胞分化与生长通路发挥保护作用,从而随时间推移降低乳腺组织的恶性转化。值得注意的是,哺乳似乎对三阴性乳腺癌(TNBC)的风险降低具有更显著的保护作用。本研究发现,经产会诱导CD8⁺ T细胞在正常乳腺组织中的积聚,其中包括具有组织驻留记忆样表型的细胞。在小鼠模型中,经历妊娠、哺乳及复旧的过程,驱动了CD8⁺ T细胞在乳腺内的积累。这一现象伴随着肿瘤生长减缓及瘤内免疫细胞浸润增加,而清除CD8⁺ T细胞则会消除这些保护效应。重要的是,这种CD8⁺ T细胞依赖性的肿瘤控制作用,仅在完成完整的哺乳及退化复原周期后才被观察到。与此一致的是,经产女性的原发性TNBC组织表现出更强的T细胞浸润和更好的临床预后。这些横跨临床前模型及逾千份患者样本的研究结果,共同揭示了生殖史如何塑造乳腺免疫,确立了CD8⁺ T细胞作为经产相关保护关键介导者的地位,并为乳腺癌的预防和治疗新策略提供了依据。

1. 经产与女性正常乳腺组织中T细胞特征的关联性
为评估生殖史如何影响正常乳腺组织的免疫状态,首先比较了经产与未产女性未患癌乳腺组织中CD8⁺ T细胞的数量和表型。通过对Reed等人整理的四个数据集中的单细胞转录组数据进行分析,发现与未产女性相比,经产女性(≥1次足月妊娠)的CD3⁺、CD8⁺以及CD8⁺织驻留记忆样T细胞(TRM)的比例显著更高。流式细胞术评估未患癌健康乳腺组织中的免疫浸润情况,发现经产女性表达组织驻留典型标志物CD69和CD103的TRM样细胞比例显著高于未产女性。多重荧光免疫组化技术进一步证实,经产女性的乳腺组织中CD69⁺CD103⁺CD8⁺ TRM样细胞群数量显著高于未产女性,这些细胞主要定位于上皮内或导管周围。CD69⁺CD103⁺CD8⁺ T细胞在妊娠后稳定维持超过30年,并且与其CD69⁺CD103⁻CD8⁺ T细胞相比,显示出更优的长期保留,这与先前观察到CD103⁺ TRM样细胞随时间推移占主导地位的结果一致。为研究与生产和哺乳相关的乳腺相关CD8⁺ T细胞质性差异,在经产乳腺TRM样细胞中鉴定出差异表达基因,包括上调的ITGAE、ITGA1和CXCR6等,称之为“经产乳腺相关(PB)-TRM特征”。对包含109例未患癌女性正常乳腺组织样本的独立数据集分析显示,与未产女性相比,经产女性组织中该特征信号呈现显著阳性富集,这证实了生育相关的转录差异。

图1. 经产与女性正常乳腺组织中T细胞特征的关联性
(图片源于《Nature》)
2. 哺乳与复旧促进健康小鼠乳腺脂肪垫中CD8⁺ T细胞的增加
随后研究不同品系(C57BL/6和BALB/c)小鼠在妊娠、哺乳及复旧阶段乳腺脂肪垫(MFP)的免疫细胞群,设置三个实验组:(i)完整自然哺乳周期(21天)后离乳,在乳腺恢复至孕前状态时(复旧后第28天,d28-inv);(ii)早期强制离乳(FW)复旧,幼鼠在出生12-24小时内移除以实现最低限度哺乳,在复旧后第10天(d10-FW);(iii)与经产鼠年龄匹配的未生育对照组(virgin),发现d28-inv组CD45+细胞总数、CD8+ T细胞总数(包括表达CD69+CD103-和CD69+CD103+的CD8+ T细胞亚群)、CD45+细胞群中CD44hiCD8+ T细胞数明显高于virgin组。为进一步表征生产相关CD8+ T细胞,我们进行了高维蛋白质组学分析。结果显示与virgin组相比,d28-inv组有三个细胞簇显著富集,这三个细胞簇均表达CD69、CD103、CD49a等经典组织驻留标记物。
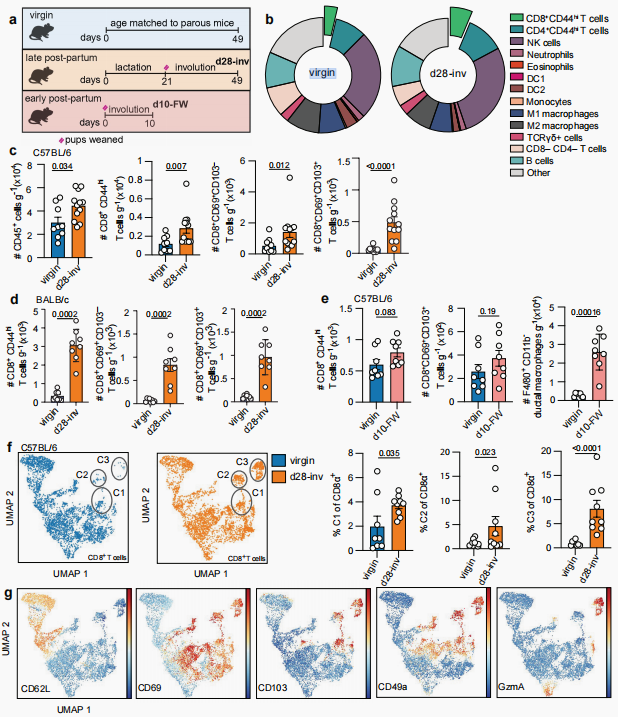
图2. 哺乳与复旧促进健康小鼠乳腺脂肪垫中CD8⁺ T细胞的增加
(图片源于《Nature》)
3. 哺乳与复旧抑制小鼠乳腺肿瘤生长
为深入探究复旧不同阶段对肿瘤进展的影响,使用TNBC原位癌小鼠模型,对比分析d28-inv、d10-FW小鼠MFP的肿瘤生长情况,并以同龄virgin小鼠作为对照。结果显示,d10-FW组小鼠的肿瘤生长与对照组无差异;而d28-inv组小鼠的肿瘤生长则显著减缓。同时发现d28-inv组肿瘤中CD8+ T细胞数量显著增加,包括CD69+CD103+组织驻留TRM细胞群,单核细胞、CD4+ Th1细胞、树突状细胞及XCR1+ I型树突状细胞也有所增加。
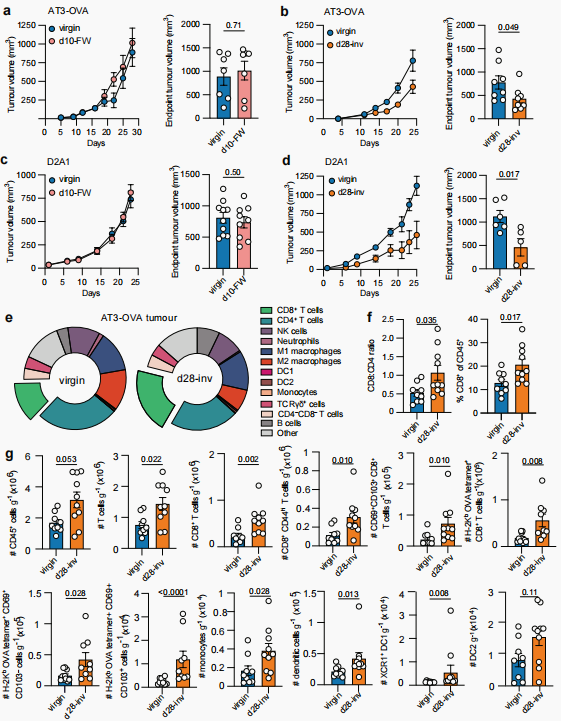
图3. 哺乳与复旧抑制小鼠乳腺肿瘤生长
(图片源于《Nature》)
4. 经产诱导的肿瘤保护由CD8+ T细胞介导
为探究经产小鼠肿瘤生长减缓是否由T细胞介导,我们在缺乏NK细胞、T细胞和B细胞的RAG2⁻/⁻γc⁻/⁻小鼠模型中,对virgin组和d28-inv组小鼠接种AT3-OVA肿瘤细胞,结果显示两组肿瘤生长无显著差异。为验证CD8⁺ T细胞能否重建保护效应,以上两组小鼠分别输注源自OT-I转基因小鼠的初始CD8⁺ T细胞,发现d28-inv组肿瘤生长显著被抑制,且d28-inv组肿瘤内CD45⁺及TCR-vα2⁺CD8⁺ T细胞数量较virgin组升高。进一步验证CD8⁺ T细胞在经产介导保护中的必要性,通过抗体清除CD8α⁺、CD8β⁺或CD4⁺ T细胞发现:单独清除CD8α或CD8β均能显著削弱d28-inv组的抗肿瘤保护,证明CD8αβ⁺ T细胞是关键效应细胞。为评估局部CD8⁺ T细胞是否足以控制肿瘤,研究人员使用S1PR1激动剂——FTY720阻断T细胞向外周迁移,经FTY720处理的d28-inv组小鼠丧失肿瘤保护能力,且肿瘤特异性CD8⁺ T细胞减少。以上数据说明,经产诱导的肿瘤保护由CD8αβ⁺ T细胞介导,哺乳及复旧期后,肿瘤攻击可同时驱动乳腺驻留T细胞扩增与循环肿瘤特异性效应细胞招募,从而增强免疫监视与肿瘤清除能力。
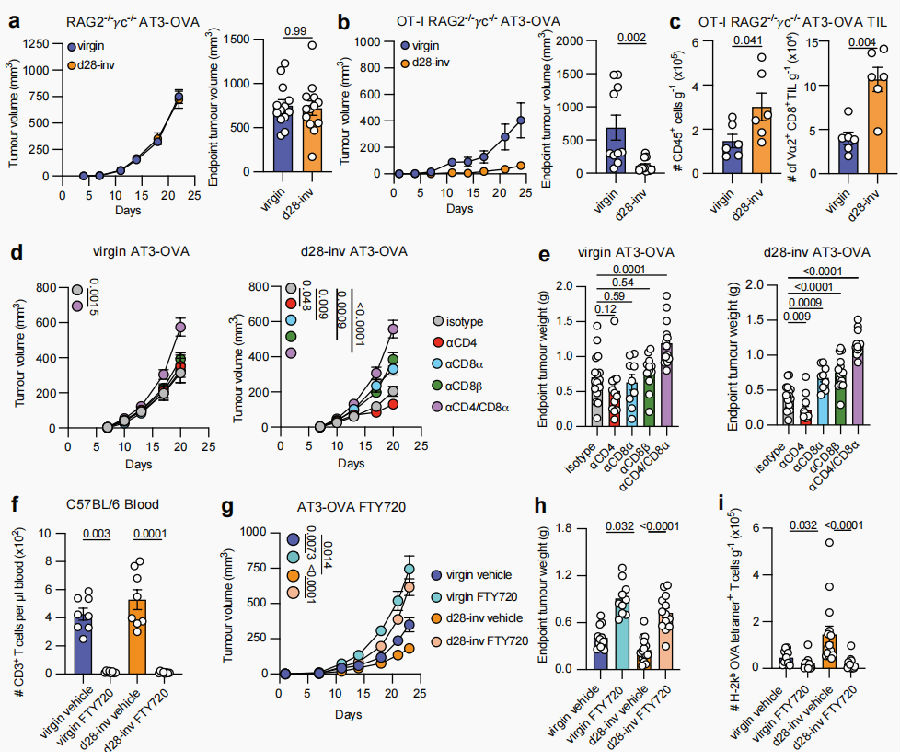
图4. 经产诱导的肿瘤保护由CD8+ T细胞介导
(图片源于《Nature》)
5. 母乳喂养与TNBC的免疫细胞浸润相关
在证实小鼠哺乳及复旧后肿瘤生长减缓依赖于CD8+ T细胞的基础上,进一步探究在人类TNBC中是否存在类似关联。研究团队分析了包含934名早期乳腺癌女性的马来西亚MyBrCa队列,发现经产且母乳喂养过的女性,其TNBC肿瘤的免疫浸润评分显著高于未生育或未母乳喂养的患者;且之前发现的PB-TRM特征基因在这些肿瘤中也高度富集,凸显了PB-TRM特征对生育和复旧的特异性。进一步研究发现,有过哺乳经历的经产女性肿瘤内CD8+ T细胞密度显著高于未生育女性。另外比较了拥有哺乳史和生存结局数据的270名澳大利亚女性的独立队列,发现哺乳患者的乳腺癌确诊后总生存期显著长于未哺乳患者,HE染色分析发现哺乳时长最长的个体肿瘤淋巴细胞浸润数量最多。确诊乳腺癌后的总体生存期比未母乳喂养的患者延长近60%(风险比HR=0.39,95% CI:0.19-0.79)。数字病理分析显示,母乳喂养时间越长,肿瘤中的淋巴细胞浸润量越多。
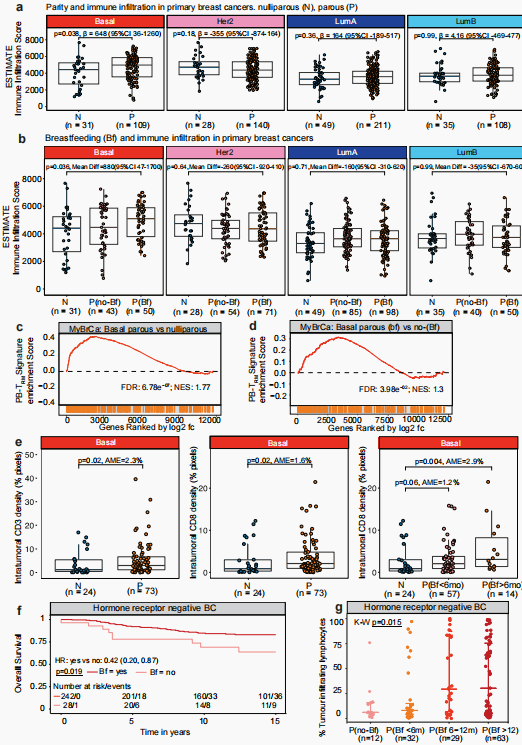
图5. 母乳喂养与TNBC的免疫细胞浸润相关
云克隆开发了涉及上述研究相关靶标的蛋白、抗体以及试剂盒产品,靶标及核心货号如下,供参考:
靶标 | 核心货号 | 靶标 | 核心货号 |
CD45 | B030 | CD3e | D117 |
CD8a | B099 | CD4 | B167 |
CD197 | B647 | CD19 | B873 |
CD69 | B207 | CD103 | B437 |
PD1 | A751 | CXCR6 | A918 |
CD39 | B118 | CXCR3 | A625 |
CD62L | A086 | Granzyme B | A600 |
Granzyme A | A599 | TCF1 | G775 |
Tbet | P605 | FOXP3 | B877 |