病毒免疫中的关键角色:RIG-I样受体
病毒免疫中的关键角色:RIG-I样受体
近期,流感病毒高发,在人与病毒漫长的共存与对抗史中,先天免疫系统始终是抵御病毒入侵的第一道防线。其中,RIG-I样受体(RIG-I-like receptors, RLRs)作为细胞内受体,在宿主抵御病原体感染,特别是病毒感染的天然免疫反应中扮演着核心角色。然而,病毒也进化出了多样的逃逸策略,与RLRs介导的免疫机制展开持续博弈。研究RLRs与病毒的相互作用,不仅为分析先天免疫调控机制提供理论基础,更为抗病毒药物研发和疫苗设计开辟新方向。
RLRs家族的核心成员
RLRs家族主要包括视黄酸诱导基因I(RIG-I)、黑色素瘤分化相关基因5(MDA5)和遗传与生理实验分子(LGP2)。这些受体通过识别细胞质中的病毒RNA,启动信号转导通路,诱导其他促炎细胞因子(如IL-6、TNF-α)的产生,从而建立抗病毒状态。LGP2可以调节RIG-I和MDA5的活性,增强或抑制它们的病毒RNA检测能力。
RIG-I样受体结构
RLRs是定位在细胞质中的RNA传感器,所有RLR都有一个中心的解旋酶结构域和一个羧基末端结构域(CTD)。这两个结构域一起检测免疫刺激性的RNA。RIG-I和MDA5另外还含有两个氨基末端的半胱氨酸蛋白酶激活和招募结构域(CARDs),它们介导下游信号转导,LGP2缺乏CARDs,并且普遍认为它调节RIG-I和MDA5。(图1)
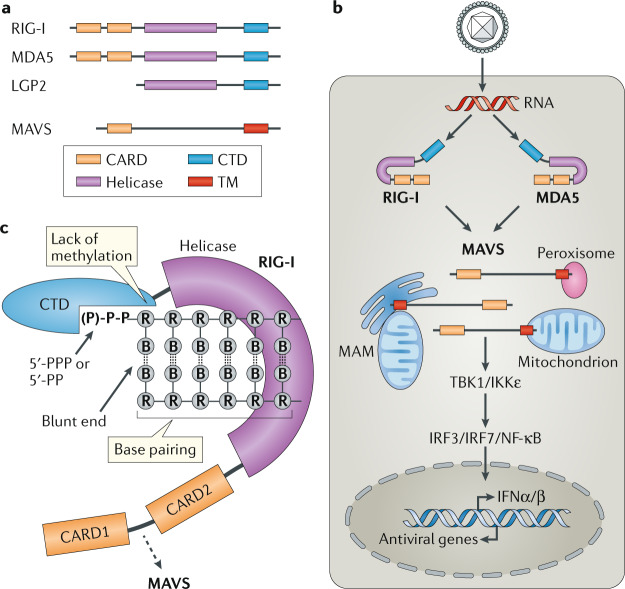
图1 RIG-I样受体结构
RIG-I样受体分布
在机体中分布广泛,除成熟红细胞等少数细胞外,几乎存在于所有组织细胞的细胞质中,尤其在免疫相关细胞(如树突状细胞、巨噬细胞、T细胞、B细胞)以及易受病毒侵袭的组织细胞(如呼吸道上皮细胞、肝细胞、消化道上皮细胞)中高表达。
RLRs对病毒的识别机制
RLRs主要识别细胞质中的病毒RNA,RIG-I和MDA5通过其DExD/H-box RNA解旋酶结构域检测病毒RNA。RIG-I主要识别包含5'-三磷酸基团的短双链RNA或单链RNA,这些RNA通常是病毒基因组或复制中间产物所特有的。例如,登革病毒(DENV)的复制型双链RNA可以被RIG-I和MDA5共同识别,从而激活天然免疫。
病毒感染诱导的肌动蛋白细胞骨架重排是RLRs激活的启动因素。肌动蛋白细胞骨架的重排可以触发蛋白磷酸酶1调节亚基12C(PPP1R12C)的激活,通过去磷酸化作用启动RIG-I样受体的活化。这意味着病毒感染不仅提供RNA配体,还通过细胞内环境的变化,为RLRs的激活创造必要条件。
RIG-I样受体信号传导途径
病毒进入细胞后,其双链RNA(dsRNA)和单链RNA(ssRNA)作为病原体相关分子模式(PAMPs)被细胞识别。RIG-I和MDA5与病毒RNA结合后,会引起构象变化,进而激活线粒体抗病毒信号蛋白(MAVS)。MAVS的激活导致肿瘤坏死因子受体相关因子3(TRAF3)的募集,TRAF3随后激活TANK结合激酶1(TBK1)和IκB激酶ε(IKKε),这些激酶磷酸化干扰素调节因子3(IRF3)和IRF7,磷酸化的IRF3和IRF7随后转位到细胞核内,诱导I型干扰素(如IFN-α和IFN-β)的转录。MAVS还会激活NF-κB信号通路,导致促炎细胞因子(如IL-1β,IL-6和TNF-α)的产生。此外,NLRP1和NLRP3炎症小体的激活也参与其中,通过Caspase-1裂解IL-1β和IL-18,并诱导细胞焦亡。总之,这些通路的激活最终促使NF-κB和IRF3进入细胞核,转录并分泌各种细胞因子,从而协调针对病毒感染的天然免疫反应。(图2)
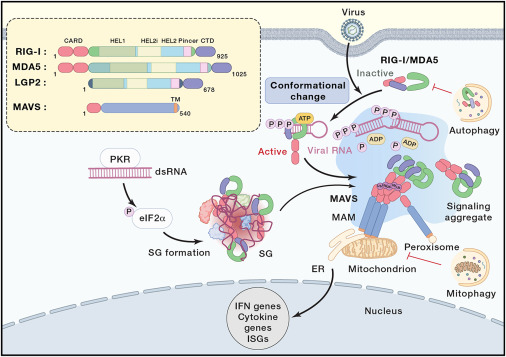
图2 病毒识别与抗病毒免疫应答
病毒对RLRs介导免疫的逃逸策略
为了成功复制和传播,病毒进化出多种策略来逃避或抑制RLRs介导的天然免疫应答。例如,严重急性呼吸综合征冠状病毒2(SARS-CoV-2)的非结构蛋白6(NSP6)能够结合TBK1,抑制I型干扰素的产生。SARS-CoV-2还会通过多种机制拮抗I型干扰素,从而逃避宿主免疫系统。
某些病毒蛋白可以直接靶向RLR信号通路的关键组分。例如,猪三角冠状病毒(PDCoV)的N蛋白和NSP5蛋白可分别与MAVS和IKK复合物相互作用,从而抑制干扰素的产生和信号传导。寨卡病毒(ZIKV)感染可诱导细胞内模式识别受体检测病毒复制产物,刺激I型干扰素的产生,但ZIKV也进化出逃逸机制来对抗宿主免疫应答。流感病毒(IAV)会拮抗RIG-I的自我识别能力,增强病毒复制。HIV-1的辅助蛋白Nef则通过稳定肌动蛋白,阻止PPP1R12C介导的RLR启动,从而抑制病毒感知。
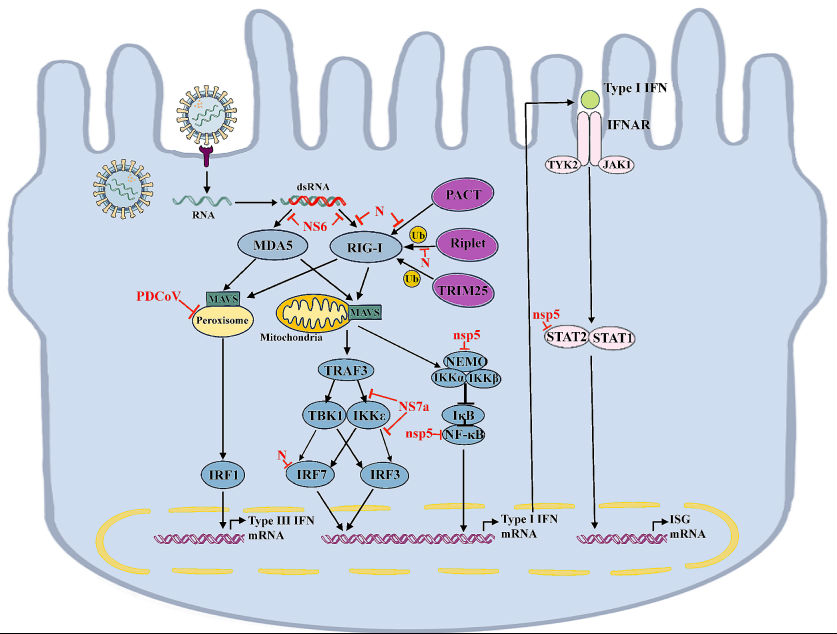
图3 PDCoV干扰干扰素信号通路的免疫逃避机制
RLRs的生理功能与病理相关性
RLRs不仅在抗病毒免疫中至关重要,其功能失调也与多种病理状态相关。例如,持续激活的RLRs可能导致免疫病理学,包括自身炎症性疾病和自身免疫性疾病。抗MDA5抗体相关皮肌炎(MDA5-DM)是一种自身免疫性疾病,其特征是MDA5蛋白被免疫系统错误攻击,导致皮肌炎和快速进展性间质性肺病。这一现象凸显了RLRs在免疫稳态中的精细调节机制。

图4 MDA-5型皮肌炎的拟议发病机制
此外,RLRs也参与到肿瘤免疫中,利用核酸传感器(包括RLRs)作为治疗靶点,可以激活抗肿瘤免疫应答。UBR5作为一种E3泛素连接酶,能够促进抗病毒免疫,其作用机制是通过解除对RIG-I样受体的转录抑制。PZR通过抑制MAVS激活来抑制RIG-I和MDA5介导的I型干扰素信号传导,从而抑制对RNA病毒感染的天然免疫反应。UBXN9通过调控GLUT4介导的RLRs空间限制,影响RLRs信号传导。这些发现揭示了RLRs功能调控的复杂性及其在免疫和疾病中的广泛影响。
总而言之,RLRs在宿主抗病毒免疫中扮演着核心角色,它们通过精准识别病毒RNA、激活多个信号通路,促使NF-κB和IRF3进入细胞核来诱导I型干扰素和细胞因子的产生。同时,病毒也发展出多样化的免疫逃逸机制来对抗RLRs的作用。深入理解RLRs与病毒之间的相互作用,对于开发新型抗病毒疗法和免疫调节策略具有重要意义。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力相关研究,部分指标节选如下,供参考。
核心货号 | 指标名 | 核心货号 | |
RIG-I | B532 | LGP2 | M852 |
MDA5 | L608 | IL6 | A079 |
IFNA | A033 | MAVS | C597 |
TNFA | A133 | TRAF3 | G753 |
PPP1R12C | P210 | IRF3 | B589 |
TBK1 | H061 | IFN-β | A222 |
IRF7 | C181 | NLRP1 | K117 |
NF-κB | B824 | Caspase-1 | B592 |
NLRP3 | K115 | IL-18 | A064 |
IL-1β | A563 | UBXN9 | J720 |
UBR5 | L075 | GLUT4 | C023 |
更多信息,欢迎访问http://www.cloud-clone.com/。
参考文献:
1.Solotchi, M., & Patel, S. S. (2024). Proofreading mechanisms of the innate immune receptor RIG-I: distinguishing self and viral RNA. Biochemical Society Transactions, 52(3), 1131–1148. https://doi.org/10.1042/bst20230724
2.Yoneyama, M., Kato, H., & Fujita, T. (2024). Physiological functions of RIG-I-like receptors. Immunity, 57(4), 731–751. https://doi.org/10.1016/j.immuni.2024.03.003
3.Shan, X., Li, R., Ma, X., Qiu, G., Xiang, Y., Zhang, X., Wu, D., Wang, L., Zhang, J., Wang, T., Li, W., Xiang, Y., Song, H., & Niu, D. (2024). Epidemiology, pathogenesis, immune evasion mechanism and vaccine development of porcine Deltacoronavirus. Functional & Integrative Genomics, 24(3). https://doi.org/10.1007/s10142-024-01346-7
4.Elliott, K. C., & Mattapallil, J. J. (2024). Zika Virus—A Reemerging Neurotropic Arbovirus Associated with Adverse Pregnancy Outcomes and Neuropathogenesis. Pathogens, 13(2), 177. https://doi.org/10.3390/pathogens13020177
5.Marques, M., Ramos, B., Albuquerque, H., Pereira, M., Ribeiro, D. R., Nunes, A., Sarabando, J., Brás, D., Ferreira, A. R., Vitorino, R., Amorim, M. J., Silva, A. M. S., Soares, A. R., & Ribeiro, D. (2024). Influenza A virus propagation requires the activation of the unfolded protein response and the accumulation of insoluble protein aggregates. iScience, 27(3), 109100. https://doi.org/10.1016/j.isci.2024.109100
6.Yang, D., Geng, T., Harrison, A. G., Cahoon, J. G., Xing, J., Jiao, B., Wang, M., Cheng, C., Hill, R. E., Wang, H., Vella, A. T., Cheng, G., Wang, Y., & Wang, P. (2024). UBR5 promotes antiviral immunity by disengaging the transcriptional brake on RIG-I like receptors. Nature Communications, 15(1). https://doi.org/10.1038/s41467-024-45141-1
7.Deng, R., Zhang, L., Chen, S., Li, X., Xue, B., Li, H., Xu, Y., Tian, R., Liu, Q., Wang, L., Liu, S., Yang, D., Li, P., Tang, S., & Zhu, H. (2024). PZR suppresses innate immune response to RNA viral infection by inhibiting MAVS activation in interferon signaling mediated by RIG-I and MDA5. Antiviral Research, 222, 105797. https://doi.org/10.1016/j.antiviral.2024.105797
8.Wang, P., Harrison, A., Yang, D., Cahoon, J., Geng, T., Cao, Z., Karginov, T., Chiari, C., Li, X., Qyang, Y., Vella, A., Fan, Z., Vanaja, S. K., Rathinam, V., Witczak, C., & Bogan, J. (2024). UBXN9 governs GLUT4-mediated spatial confinement of RIG-I-like receptors and signaling. In Research Square. Springer Science and Business Media LLC. https://doi.org/10.21203/rs.3.rs-3373803/v1