一种新的细胞程序性死亡——细胞焦亡
细胞焦亡(Pyroptosis),又称细胞炎性坏死,是一种新近发现的细胞程序性死亡方式。表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。细胞焦亡广泛参与感染性疾病、神经系统相关疾病和动脉粥样硬化性疾病等的发生发展,对细胞焦亡的深入研究有助于为临床防治提供新思路,近几年,细胞焦亡的研究热度迅猛上升,已成为一个新的研究热点。
2001年,Cookson和Brennan最早提出了细胞焦亡的概念,用来形容炎症细胞中的一种依赖于Caspase 1的细胞死亡方式,这是一种完全不同于细胞凋亡的死亡方式。与细胞凋亡相比,细胞焦亡发生的更快,并伴有大量促炎因子释放。那么,细胞焦亡发生的机制如何?研究细胞焦亡又会对生命科学领域带来怎样的意义呢?以下,我们从细胞焦亡发现的历程逐渐阐明其发生的机制、原理及研究意义。
自自提出细胞焦亡概念的很长一段时间,其机制一直没有重要的进展。直到2015年9月,由北京生命科学研究所邵峰团队在《Nature》在线发表“Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death”,该研究首次阐明细胞焦亡的关键分子机制。GSDMD属于一个被称为gasdermin的功能未知的蛋白家族,该家族还包括GSDMA,GSDMB,GSDMC,DFNA5,DFNB59等。研究发现GSDMD是所有炎性Caspases(包括:Caspase 1/4/5/11)的一个共有底物蛋白,这些炎性Caspases特异性的切割GSDMD两个结构域中间的连接区域,而凋亡相关的Caspases(Caspase 2/3/6/7/8/9/10)却不能。在细胞中表达基因工程改造的GSDMD,可以使细胞在其它蛋白酶刺激下发生焦亡,甚至可以将细胞凋亡转化为焦亡。这些结果证明GSDMD的N端结构域具有诱发细胞焦亡的活性,GSDMD在被炎性Caspases切割后释放出来的N端结构域就足以引发细胞焦亡,GSDMD蛋白的切割对于炎性Caspases激活引发的细胞焦亡是必要且充分条件。
2016年6月,由王大成和邵峰院士合作于《Nature》在线发表“Pore-forming activity and structural autoinhibition of the gasdermin family”,研究证实GSDMD是炎性Csapases诱导细胞焦亡的直接作用分子,首次揭示了gasdermin 家族蛋白的N端结构域具有在膜上打孔进而破坏细胞膜的功能。同年7月,来自波士顿儿童医院细胞与分子医学计划的Judy Lieberman博士和Hao Wu博士在《Nature》在线发表“Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores”,该研究揭示了败血症和阻止细菌攻击所需的终末细胞事件。研究证实,炎性Caspases经激活后切割GSDMD释放出活性片段,即GSDMD-NT,GSDMD-NT在胞膜聚集形成电子显微镜可见的膜穿孔,从而快速杀死细胞,引发炎症性坏死(即细胞焦亡)并释放大量炎性因子,如:IL1b,IL18。同时,体外研究结果表明GSDMD-NT可直接杀死宿主细胞外的细菌,为协助治疗细菌感染提供了新思路,为败血症及自身免疫疾病的治疗提供了理论基础。
2017年5月,邵峰团队又一次在《Nature》在线发表“Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a Gasdermin”,研究发现,和GSDMD类似,Caspase 3特异性切割活化的GSDME,可在膜上打孔并触发细胞焦亡。以高表达GSDME的正常细胞和癌细胞作为研究对象,用化疗药物进行处理,发现表达GSDME阳性的细胞发生焦亡,并同时伴随Caspase 3依赖的GSDME切割,而不表达GSDME的细胞则发生凋亡,并在GSDME阳性细胞中用RNAi敲低GSDME表达后,化疗药物引起的细胞焦亡转换为凋亡。该研究揭示了细胞焦亡向细胞凋亡转换的关键分子机制,并提示GSDME介导的细胞焦亡很可能是化疗药物产生毒副作用的重要原因,为癌症治疗提供了新思路。
2020年2月,邵峰团队在《Cell》在线发表“Structural mechanism for GSDMD targeting by autoprocessed caspases in pyroptosis”,该研究在国际上首次完整地揭示了天然免疫应答中Caspase精确地自剪切活化,进而特异地识别和切割GSDMD,触发细胞焦亡的分子机制。
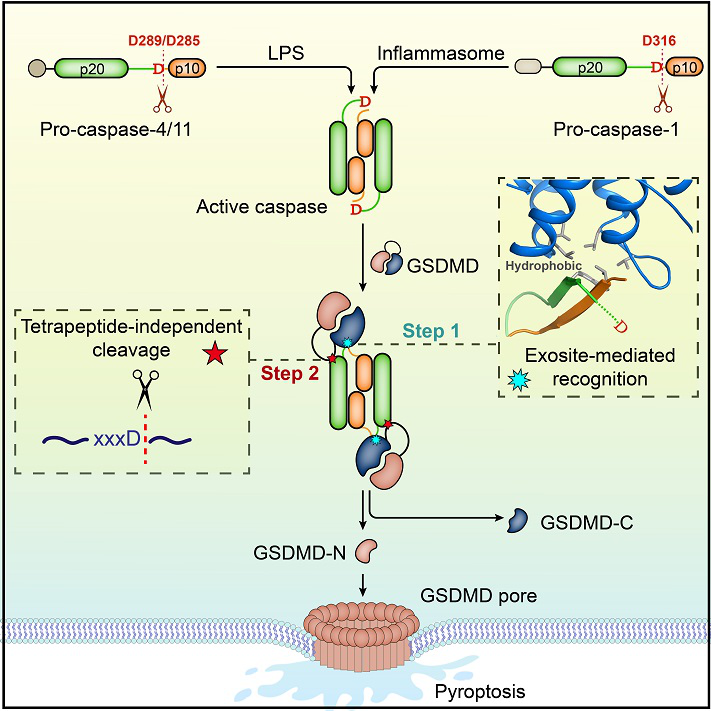
(图片来源:《Cell》杂志)
2020年3月,两篇以细胞焦亡为研究热点的文章同时发表于《Nature》,一篇是美国Judy Lieberman博士和张志斌博士研究团队发表的“Gasdermin E suppresses tumor growth by activating anti-tumor immunity”,该研究揭示了肿瘤中GSDME通过增强肿瘤浸润性NK细胞和CD8+T细胞的抗肿瘤功能从而发挥抑瘤作用。另一篇是邵峰团队的“A bioorthogonal system reveals antitumour immune function of pyroptosis”,该研究揭示了少部分的肿瘤细胞发生焦亡,就足以有效调节肿瘤免疫微环境,进而激活很强的T细胞介导的抗肿瘤免疫反应。同年4月,邵峰团队在《Sceience》在线发表“Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells”,该研究发现在细胞毒性淋巴细胞杀伤靶细胞的过程中,细胞毒性淋巴细胞来源的Granzyme A切割GSDMB使其具有打孔活性,能够特异地高效激活GSDMB蛋白,从而触发靶细胞焦亡,该分子机制可以增强抗肿瘤免疫。以上研究为肿瘤免疫治疗提供了新思路。
以下为部分细胞焦亡相关靶标:
蛋白名称 | 云克隆核心货号 | 蛋白名称 | 云克隆核心货号 |
GSDMA | E531 | GSDMB | E530 |
GSDMD | E529 | Granzyme A | A599 |
Caspase 1 | B592 | Caspase 3 | A626 |
Caspase 4 | B735 | Caspase 5 | A770 |
TNF-a | A133 | IL1b | A563 |
IL18 | A064 | IFN-y | A049 |
IFN-a | A033 | IFN-b | A222 |