ITLN1通过代谢转移抑制卵巢癌细胞的发展

2020年7月15日,来自密歇根大学生物医学工程系的Deepak Nagrath 教授和德克萨斯大学MD安德森癌症中心的Samuel C. Mok 教授在《Nature communications》联合发表了题为“ITLN1 modulates invasive potential and metabolic reprogramming of ovarian cancer cells in omental microenvironment”的文章。研究探讨了调节卵巢癌扩散到大网膜组织的分子机制,发现ITLN1通过降低MMP1的表达和诱导转移性卵巢癌细胞的代谢转移,抑制了乳转铁蛋白对卵巢癌细胞侵袭潜能和增殖的影响。此外,接受ITLN1治疗的卵巢癌小鼠肿瘤生长速度明显下降。这些数据表明,在大网膜肿瘤微环境中,来自间皮细胞的ITLN1的下调促进了卵巢癌的发展。

产品:内凝集蛋白1 ELISA Kit
货号:SEA933Mu
实验方法:双抗夹心
检测范围:2.5-160pg/mL
研究简介:
上皮性卵巢癌(Ovarian cancer, OC)是美国死亡人数最多的妇科恶性肿瘤。它最常见于绝经后妇女,并优先转移到大网膜。大网膜是一种血管化良好的腹膜组织皱褶,是腹腔内脂肪聚集的主要部位。这些观察结果表明,内脏脂肪作为转移微环境的组成部分,可能对OC的发展产生负面影响。然而,大网膜内脏组织促进肿瘤生长和疾病进展的机制尚不完全清楚。以往的研究表明,脂肪组织可能对肿瘤的生长、转移和化疗敏感性有直接的、局部的影响。
许多研究表明,肿瘤细胞与间皮细胞的透明质酸膜结合,以及炎症介质和潜在的细胞外基质暴露引起癌细胞粘附分子的上调,可能促进癌细胞的附着和侵袭。然而,OC的间皮细胞的在细胞粘附和增长的确切作用尚不清楚。并且,OC细胞在网膜脂肪组织中调控间皮细胞以及其他类型的细胞以创建一个环境支持他们的成长和发展的分子机制也没有进行过彻底的探索。
首先,作者对良性妇科疾病患者显微解剖的大网膜脂肪组织和高度严重卵巢癌(High-grade serous ovarian cancer,HGSC)患者的癌相关大网膜组织进行了转录组分析,发现HGSC患者的大网膜脂肪组织中ITLN1下调最多,说明OC细胞下调了大网膜脂肪组织中ITLN1的表达。同时,对健康女性的大网膜脂肪组织和HGSC患者的腹水衍生的间皮细胞进行RNA-Seq,发现ITLN1是癌症相关间皮细胞中表达下调最多的基因。
基于间皮细胞是大网膜组织的主要成分之一,作者推测大网膜脂肪组织中的ITLN1主要是由间皮细胞产生的。通过比较健康女性和HGSC患者原代间皮细胞中ITLN1的mRNA和蛋白水平并对ITLN1进行免疫定位,发现在大网膜的各种细胞中,内源性ITLN1只有间皮细胞高表达,而间皮细胞中ITLN1的下调与大网膜微环境中OC细胞或细胞分泌的介质的存在有关。
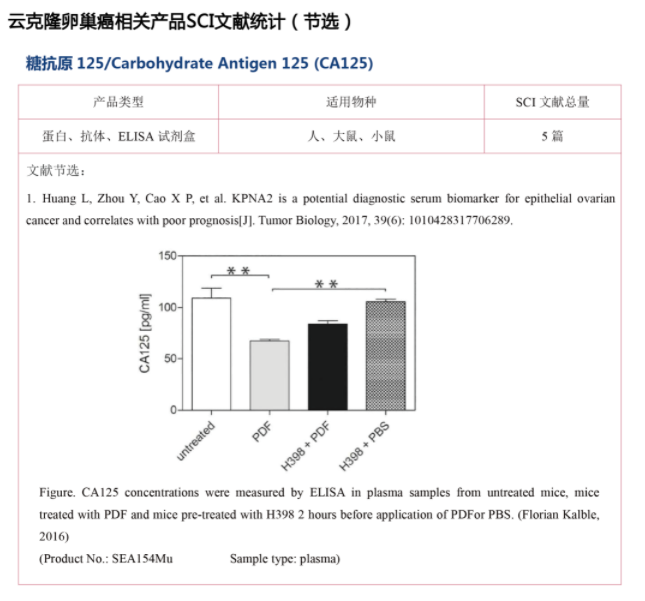
因为ITLN1是一种分泌蛋白,因此作者检测了测定了健康女性血清样本中的循环ITLN1水平,以及术前HGSC患者和良性妇科疾病患者的血清样本。结果发现,与健康女性或良性妇科疾病患者相比,HGSC患者循环中的ITLN1水平显著降低。由于OC患者血清中CA125蛋白水平升高,作者对患者血清中CA125和ITLN1蛋白水平之间是否存在相关性进行实验。发现HGSC患者的CA125水平明显高于正常女性或良性妇科疾病患者,并且CA125和ITLN1水平之间存在显著的负相关。之后使用logistic回归法构建了ITLN1、CA125或两者的受试者工作特征曲线以检验健康女性和OC女性之间的区分能力。数据表明,ITLN1补充了CA125在OC患者识别中的作用。
为了评估ITLN1在OC进展中的作用,作者进行了细胞侵袭实验和迁移实验。发现与磷酸盐缓冲生理盐水(PBS)处理的SKOV3和A224相比,ITLN1处理的细胞的行走距离明显缩短,侵袭程度明显降低。说明外源性ITLN1可以抑制OC的转移。为了确定ITLN1抑制OC细胞运动和侵袭电位的分子机制,作者对外源性ITLN1处理的A224进行了转录组分析。从转录组中,作者选择了与侵袭和转移相关的基因MMP1进行研究。因为mRNA 和蛋白在ITLN1处理的SKOV3和A224细胞中均下调,表明MMP1介导了ITLN1对OC细胞运动和侵袭电位的影响。
为了确定ITLN1下调MMP1的信号网络,作者首先将目标放在LTF(Lactotransferrin)上。前人研究发现LTF能与膜结合形式的ITLN1互作,并且LTF与LRP1(Low-intensity lipoprotein-receptor-related protein 1)结合转录上调MMP1。因此推测ITLN1与LTF结合,阻止LTF与OC细胞上的受体LRP1结合,进而导致MMP1下调。首先,作者进行了体外pull-down实验表明ITLN1和LTF结合。通过Duolink PLA技术进一步证明ITLN1干扰了OC细胞上LTF与LRP1的结合。作者发现大部分LTF信号在大网膜组织中共定位,提示中性粒细胞是大网膜肿瘤微环境中LTF的主要来源。并且通过免疫组化分析,HGSC患者的癌相关脂肪组织中LTF表达显著上调。HGSC患者腹水中富含中性粒细胞的LTF水平明显高于任何一组患者的血清。Logistic回归法构建工作特征曲线,发现LTF联合ITLN1和CA125时的曲线下面积明显大于单独联合CA125时的曲线下面积,说明LTF联合ITLN1在OC患者识别中可补充CA125。
作者将ITLN1在含有10%胎牛血清(FBS)的抗LTF抗体或IgG的培养液中处理OC细胞,与SFM种相比,细胞运动和侵袭电位明显提高;当ITLN1加入后,运动和侵袭明显下降。这表明ITLN1抑制了LTF对OC细胞运动和侵袭的影响。当SKOV3和A224转染MMP1-specific siRNAs然后用LTF处理后,发现LTF对OC细胞的运动和侵袭影响消失,这表明LTF对OC细胞的影响可能通过MMP1介导。
在检测了LTF/LRP1/MMP1通路中关键中间信号分子在SKOV3和A224中的表达水平后发现,ITLN1可以消除LTF对这些信号分子的激活作用。此外,研究发现LTF处理的SKOV3和A224的应力纤维形成和细胞内钙显著增加。然而,ITLN1的加入却减弱了LTF的作用,这表明ITLN1通过调节OC细胞中钙和应力纤维的形成,减弱了LTF的促进基序的作用。
之后,作者发现ITLN1对OC细胞的生长没有直接影响,但是OC细胞和成熟脂肪细胞和ITLN1共培养的细胞生长速率显著下降,将成熟脂肪细胞替换为前脂肪细胞和间皮细胞未观察到生长抑制作用,这说明只有成熟脂肪细胞介导了ITLN1对OC细胞的生长抑制作用。
然后,作者证实ITLN1仅在成熟的脂肪细胞中增加了胰岛素依赖性的葡萄糖摄取,而葡萄糖能介导OC细胞的生长。实验发现,在胰岛素存在的情况下,ITLN1上调了脂肪细胞中GLUT4的表达,导致葡萄糖摄取增加。然而,在ITLN1处理的成熟脂肪细胞中,与对照组相比,在没有胰岛素的情况下,GLUT4 mRNA的表达没有显著变化。沉默GLUT4后ITLN1处理的成熟脂肪细胞葡萄糖摄取量显著降低。这表明ITLN1通过上调GLUT4来增加脂肪细胞的葡萄糖摄取,从而抑制OC的生长。

卵巢癌是女性生殖系统恶性肿瘤中死亡率最高的疾病。卵巢癌早期症状不明显,约65%的患者确诊时已处于晚期,死亡率较高。早期诊断者5年生存率可达92%,但是临床上仅有15%的患者在此阶段被确诊。由此可见卵巢癌的生存率有赖于早期的诊断和治疗,卵巢癌生物标志物具有采样简单、操作方便等多方面的特点,被认为是理想的早期诊断指标和预后跟踪指标。
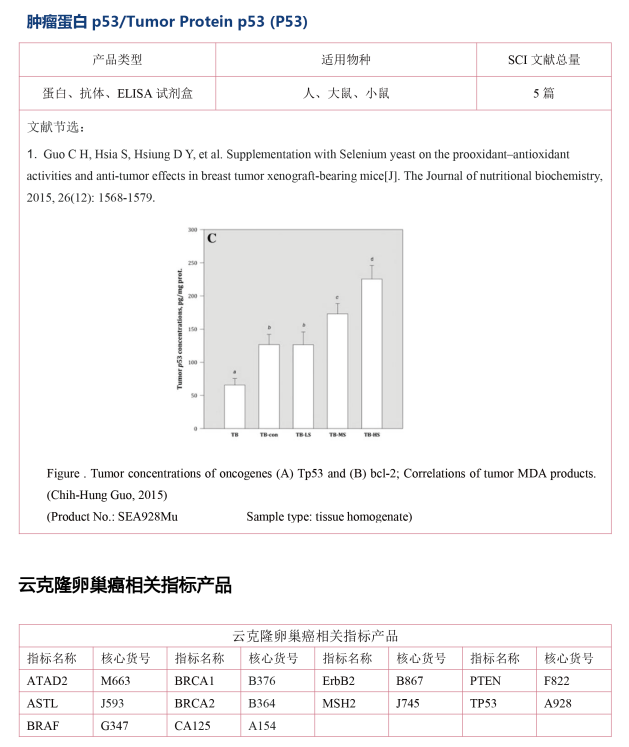
云克隆提供卵巢癌生物学标志物相关的多种指标蛋白、抗体以及ELISA试剂盒产品,广泛的应用于人、小鼠、大鼠、猪、羊等多个物种的检测。
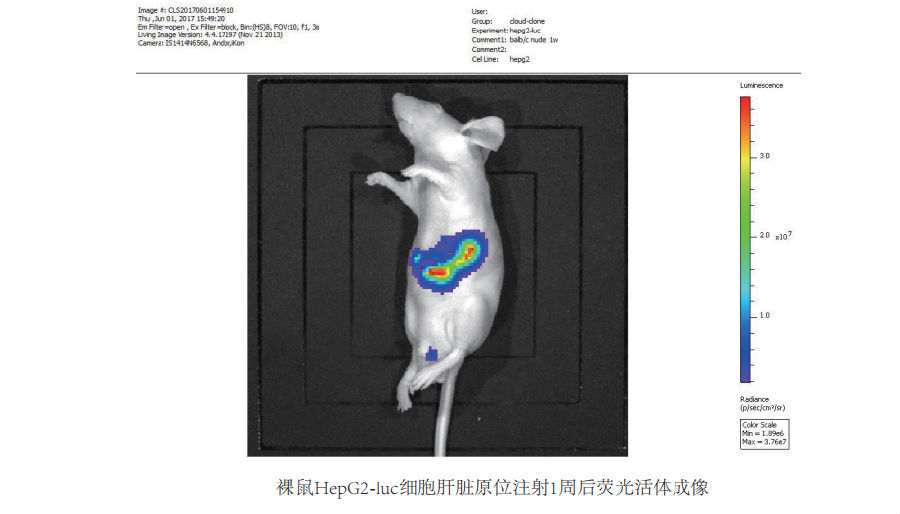
裸鼠成瘤模型
皮下成瘤
动物品系:SPF 级无胸腺 Balb/C-nude 裸鼠,雄性,周龄为 4-5W,体重为 15-20g
建模方法:将标准条件下培养的处于对数生长期的 HepG2 细胞消化、离心,将所得的约 5×10^6个细胞溶于 0.1 mL DMEM 培养液,注射于裸鼠右侧背部皮下。

肝脏原位成瘤
动物品系:SPF 级胸腺 Balb/C 裸鼠,周龄为 4-6W,体重为 15-20g
建模方法:将标准条件下培养的处于对数生长期的 HepG2-luc 细胞消化、离心,将所得的约 5×10^6个细胞溶于 0.1 mL DMEM 培养液待用。麻醉小鼠,待麻醉生效后,开腹暴露肝脏,用 1ml胰岛素注射针取准备好的细胞注射于裸鼠肝脏内,用 5-0 丝线缝合伤口,活力碘消毒伤口,将裸鼠放在加热垫上,待清醒后正常饮食饲养。活体成像检测:在成瘤后对裸鼠进行荧光活体成像检测,成像前麻醉小鼠,再通过腹腔注射 3mg 底物 luciferin,底物注射 10 分钟后进行荧光活体成像检测。图 1 为裸鼠 HepG2-luc 细胞肝脏原位注射 1 周后荧光活体成像图。