“最漫长的告别”-阿尔兹海默症和B细胞的关系
在您周围是否有这样的老人呢?短期记忆力下降;脾气开始变的暴躁;做事总是“丢三落四”,说话颠三倒四,让人很难理解;总是找不到回家的路。这些是阿尔兹海默症最明显的特征。有人把这种病叫作“最漫长的告别”。

阿尔茨海默病(AD)是一种进行性神经退行性疾病,主要影响老年人。研究表明它与脑实质中有毒蛋白聚集物的清除障碍有关,如异常裂解的淀粉样蛋白前体蛋白(APP)产生的淀粉样蛋白-β(Aβ)肽。虽然在星形胶质细胞和TGFβ的帮助下,常驻小胶质细胞可以吞噬细胞外Aβ斑块,但是慢性炎症和Aβ的产生会破坏这个过程的稳态,导致细胞增殖和随后疾病相关的小胶质细胞(DAM)取代稳态小胶质细胞。
近期美国马里兰州巴尔的摩国家老龄研究所免疫学和分子生物学实验室在Nature Communications 上发表了一篇关于阿尔茨海默病中B细胞作用的研究成果,对阿尔茨海默病的治疗有较大的意义。

研究者使用三种转基因AD小鼠模型,3xTgAD小鼠(早期发病的模型)、APP / PS1小鼠模型、5×FAD小鼠模型。通过将这三种模型小鼠与JHT小鼠杂交而生成了B细胞缺陷型小鼠(BKO),这些小鼠由于免疫球蛋白JH基因座缺失而终止了功能性B细胞,从而在pro-B细胞阶段终止了B细胞的发育。使用莫里斯水迷宫(MWM)任务对它们进行评估,发现3×TgAD小鼠相关的行为障碍需要B细胞 。与年龄和性别相匹配的APP / PS1或WT同窝幼仔相比,B细胞缺陷显着改善了APP / PS1小鼠的学习缺陷。 因此,APP / PS1表现出的空间学习障碍是B细胞依赖性的。
对脑切片中的Aβ斑块和离子钙结合适配体1(Iba1,小胶质细胞标记物)进行了免疫荧光分析。结果显示APP / PS1和3xTgAD小鼠(与健康对照小鼠相比)的Aβ斑块明显上调,而APP / PS1-BKO和3xTgAD-BKO小鼠则分别逆转。因此,B细胞缺乏的益处可能在于减少Aβ肽的形成和/或增加Aβ肽的清除。
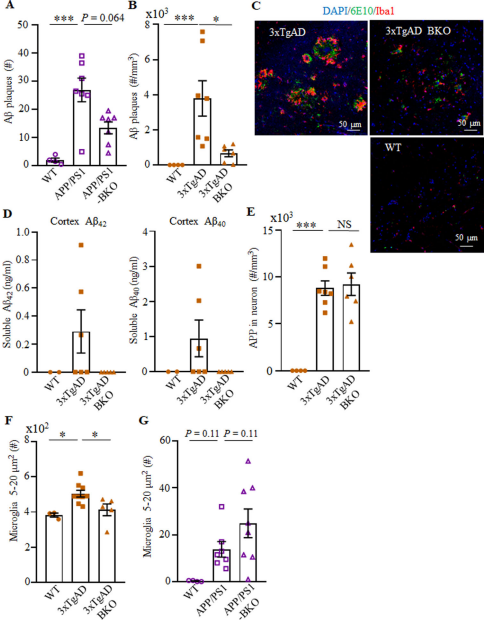
图 B细胞缺乏症可减轻AD小鼠海马的Aβ斑块负担和小胶质细胞活化。 A–C显示APP / PS1(A)和3×TgAD(B)(n = 4–7)小鼠中Aβ斑块的数量,以及WT,3×TgAD和 3 x TgAD BKO小鼠免疫荧光染色的示意图(C,Aβ斑块(绿色),Iba1 +小胶质细胞(红色)和DAPI(蓝色))。 D 3×TgAD-BKO小鼠逆转了3×TgAD小鼠大脑中可溶性Aβ1–40和Aβ1–42肽的增加。 E显示了指定小鼠(n = 2–6)皮层中ELISA的结果,B细胞缺陷并不影响转基因的表达,因为3xTgAD和3xTgAD-BKO都在海马神经元中高度表达了转基因hAPP。 F B细胞缺乏显着降低了3×TgAD中大胶质细胞(5–20μm2)的数量(#),但未降低APP / PS1小鼠(G)。
为了测试是否可以通过在疾病发作时通过治疗性灭活或B细胞耗竭来控制疾病,对3xTgAD小鼠(60-70周龄,雌性)进行了腹腔注射抗CD20 / B220抗体(消耗了循环中的B细胞),为期2个月。对照小鼠用同种型匹配的IgG治疗。抗CD20 / B220 抗体有效地消耗了循环中的B细胞。 与对照处理的小鼠相比,抗CD20 / B220 Ab处理的3xTgAD在OFA中显示出活性增加的趋势。该处理显著减少了AD小鼠亚支中Aβ斑块的数量,但并未影响海马中大(> 50 µm2)Iba1和小胶质细胞的数量。B细胞的丢失会增加TGFβ+小胶质细胞,并下调海马中Trem2,Clec7a和Itgax的表达,即用小胶质细胞替代DAM,从而消除了Aβ寡聚体和其他神经毒性碎片,减少了Aβ斑块并改善了AD小鼠行为障碍。推测B细胞在人中同样参与早发性AD模型,因为患有轻度AD的人的疾病严重程度与循环中双重负记忆CCR6 + B细胞的积累有关。研究者提出B细胞的失活也可以使AD患者受益,因为治疗性B细胞的去除甚至在疾病发作时也可以逆转小鼠中AD的表现。
尽管人们认为B细胞不会渗入AD大脑,但将其在脑实质中的存在与疾病的进展联系起来,在疾病发作时对B细胞的治疗性消耗消除B细胞及其免疫球蛋白在大脑中的沉积并阻断了AD的表现,可以将B细胞作为控制疾病进展的靶标。
目前,全球有许多学者正在对阿尔兹海默症进行着大量的不同方面的研究,力求能攻克这种病症。针对该病的研究。云克隆也为广大研究者提供检测试剂相关服务,相关指标货号如下: