TNIP3通过调控Hippo-YAP通路缓解肝缺血/再灌注损伤

文献导读
2021年6月16日,来自武汉大学基础医学院的张鹏教授、杨海龙教授和李红良教授在《Hepatology》上联合发表了题为“TNIP3 is a novel activator of Hippo-YAP signaling protecting against hepatic ischemia/reperfusion injury”的文章。

研究介绍
肝缺血/再灌注(I/R)是肝移植、肝切除和其他手术中不可避免的,是早期移植失败、组织损伤、器官排斥甚至肝功能衰竭的关键原因。尽管据报道预处理和后处理可改善肝脏I/R损伤,但这些策略仅对少数临床实践中缺血持续时间相对较长且肝切除量较小的患者有效。目前,尚未批准用于预防或治疗I/R触发的肝损伤的药理学方法。事实上,肝脏可以耐受缺血引起的急性氧中断、糖原消耗和ATP缺乏。然而,在再灌注阶段,突然强烈的氧化应激和炎症反应会直接诱导广泛的肝细胞损伤和坏死。这些病理事件相互促进,从而导致严重甚至不可逆的肝功能障碍。因此,阻断这种恶性循环将有效改善肝损伤,并有助于开发新的临床干预措施以改善手术预后。
TNFAIP3 相互作用蛋白3(TNIP3),也称为NF-κB激活3(ABIN3),最初被鉴定为TNFAIP3 结合蛋白和脂多糖(LPS)诱导的NF-kB 激活负调节因子。在肝脏中,TNIP3的腺病毒基因转移可以降低LPS诱导的NF-κB信号活性,从而部分阻断 LPS/D-(+)-半乳糖胺诱导的小鼠死亡率。值得注意的是,TNIP3通过直接结合TGFβ激活激酶1(TAK1)并以不依赖 TNFAIP3的方式抑制其激活,这对于改善非酒精性脂肪性肝炎(NASH)有很大的作用。然而,TNIP3在肝I/R损伤中的功能仍然未知。
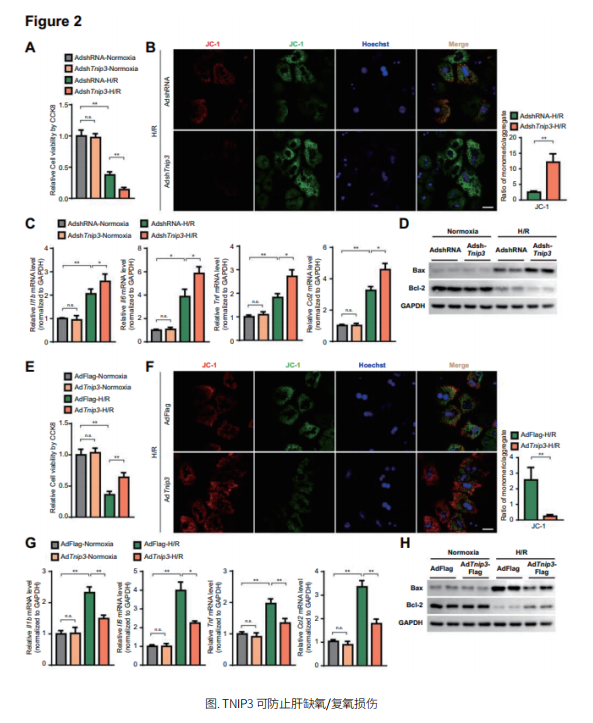
作者在分析人体和小鼠肝脏缺血再灌注样本的过程中,发现TNIP3蛋白及mRNA表达上调,利用生物信息学手段以及基因沉默实验验证,发现TNIP3 mRNA表达上调是由于上游转录因子ATF3的调控所致。在小鼠原代肝细胞缺氧/复氧模型中,腺病毒沉默TNIP3可加重肝细胞损伤,而腺病毒超量表达TNIP3则可缓解肝细胞损伤。与此同时,在TNIP3基因修饰小鼠的缺血再灌注模型中,也得到了类似的结论,即敲除TNIP3可加重肝细胞损伤,而超量表达TNIP3则可缓解肝细胞损伤。利用转录组学数据,分析TNIP3超量表达/敲除鼠在缺血再灌注中信号通路的变化,发现Hippo-YAP信号通路变化最为显著,通过Western-blot实验进一步筛查,发现TNIP3可通过促进LATS2的降解来激活YAP的活性,进而抑制肝细胞的炎症、凋亡,促进肝细胞的增殖,最终缓解肝细胞损伤。这揭示了NF-кB活性抑制蛋白TNIP3还可以通过协助LATS2的泛素化和降解以及由此产生的YAP激活来减轻细胞死亡和炎症,通过调控Hippo-YAP通路来缓解肝脏缺血再灌注损伤。总之,这项研究加深了对肝脏缺血再灌注损伤调控机制的认识和理解,为肝脏缺血再灌注损伤的治疗提供了潜在分子靶点与新思路。