治疗肥胖和相关疾病的新靶点
能量摄入和能量消耗的持续失衡导致了肥胖,进而导致一种称为代谢综合征的常见疾病,并伴有各种合并症,包括2型糖尿病、高血压、非酒精性脂肪性肝炎 (NASH)、心血管疾病和癌症。全球有19亿成年人超重,6亿人肥胖,预计到2030年全球 51% 的人口将肥胖。因此,肥胖症是一个主要的全球健康问题,其发病率越来越令人担忧。
肥胖治疗新靶点
尽管研究者们努力寻找安全、有效的肥胖治疗方法,但目前的选择是有限的,这主要是由于对脂肪积累的病理生理学和机制的了解不足。此外,由于严重的副作用,许多治疗剂已被撤回。减肥手术是减轻体重的最有效选择,但由于存在手术并发症、死亡和再次手术的风险,因此仅限于病态肥胖患者。迫切需要更多地了解所涉及的机制,以找到促进减肥和改善代谢综合征的新候选药物。
1.肝因子妊娠区蛋白(PZP)通过激活棕色脂肪组织控制饮食诱导的产热
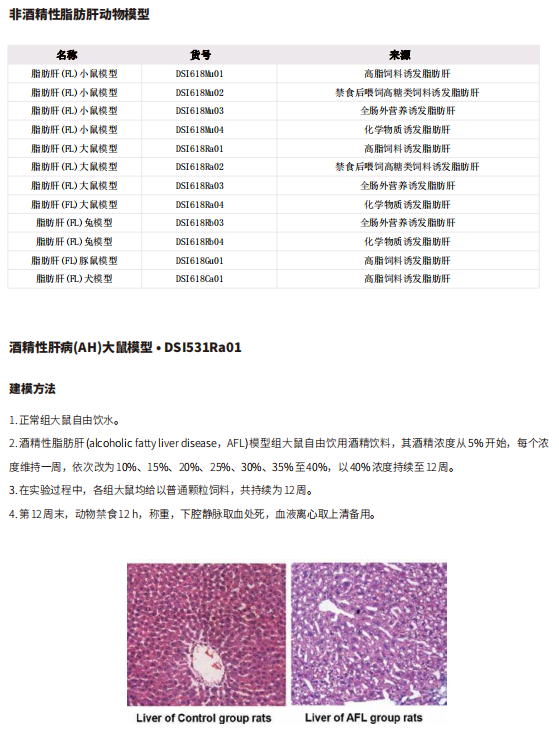
间歇性禁食 (IF) 作为减肥的饮食干预措施,主要通过增加能量消耗来发挥作用。全身能量平衡的器官间串扰,特别是棕色脂肪组织(BAT)激活介导的抗肥胖,是减肥领域的一个新前沿。2021年9月13日,中国科学院动物研究所Wanzhu Jin及团队在《Advanced Science》上发表文章定义了一个以前未被认识的跨器官通信系统,即 IF 通过肝脏与BAT 相互作用改善全身代谢,这对于 IF 诱导的代谢重塑至关重要[1]。他们发现禁食再进食信号诱导肝脏产生PZP并将其释放到循环中,随后GRP78易位到 BAT 中的细胞表面。PZP-GRP78 相互作用通过 p38 MAPK-ATF2 信号促进 UCP1 表达,促进BAT产热(图1)。需要进一步的临床研究来探索 PZP 的治疗潜力,以开发治疗肥胖和相关疾病的精准医学。
2.Bmal1缺乏可预防高脂喂养引起的肥胖
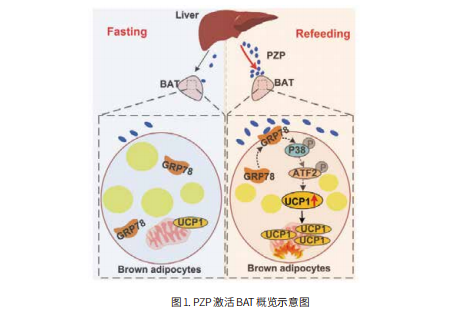
为了阐明肥胖及其并发症的发病机制,来自比利时布鲁塞尔鲁汶大学的Eleonore Maury团队研究了人体脂肪组织中生物钟和 NF-κB 通路之间的相互作用[2]。他们发现肥胖患者的网膜脂肪的生物钟功能受损。NF-κB 与 BMAL1 竞争某些靶标的转录控制。肥胖会在人类网膜脂肪中重新定位全基因组的 BMAL1 占有率,从而改变参与代谢炎症和脂肪组织重塑的众多靶基因的转录,最终导致生物钟功能障碍。这种障碍可通过抑制 NF-κB 与代谢受损一起得到纠正。此外,广州中医药大学的 Baojian Wu团队于2021年9月7日发表在《Nature Communications》上的文章报告了肠道生物钟在能量稳态中的作用[3]。他们展示了在肠道中特异性缺失 Bmal1 的小鼠在日常饮食中具有正常的表型,而在高脂肪饮食(HFD)中,这类小鼠可防止肥胖和相关异常(如高脂血症和脂肪肝)的发展(图2)。机制研究发现,BMAL1 通过直接结合启动子中的 E-box 反式激活 Dgat2 基因(编码三酰甘油合成酶 DGAT2),从而促进膳食脂肪吸收。此外,SR9009 靶向 REV-ERBα/BMAL1可改善 HFD 诱导的小鼠肥胖。这些研究表明靶向BMAL1可能是治疗由过量脂肪摄入引起的代谢疾病的一种有前景的方法。
3.抑制脂肪细胞中IL-17A轴可抑制饮食诱导的小鼠肥胖和代谢紊乱
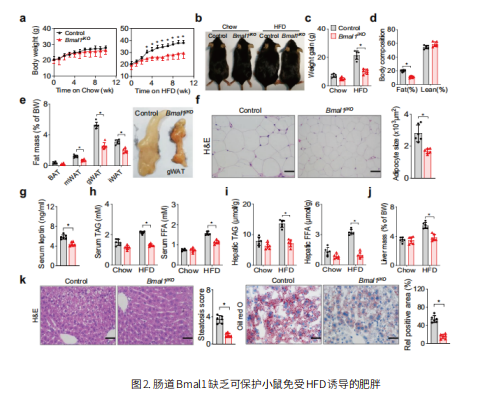
来自西班牙国家癌症研究中心的Nabil Djouder 及团队发表在《Nature Metabolism》上的文章显示[4],通过地高辛抑制RORγt 介导的白细胞介素 17A( IL-17A)生成或通过普遍缺失 IL-17 受体 A(IL17RA)来消除小鼠的IL-17A轴,抑制饮食诱导肥胖 (DIO) 和代谢紊乱,并促进脂肪组织褐变、产热和能量消耗。响应 DIO 产生的 IL-17A 以 CDK5 依赖性方式诱导脂肪细胞中 Ser273 位点的 PPARγ磷酸化,从而改变致糖尿病和肥胖基因的表达,这与病态肥胖个体白色脂肪组织中的 IL-17A 信号传导相关(图3)。这提示针对 IL-17A 轴可能是一种有效的抗肥胖策略。
云克隆不仅可提供多种代谢紊乱疾病动物模型,涵盖糖尿病、高尿酸、高血糖、非酒精性脂肪肝等常见疾病。还具有各类代谢紊乱检测指标及上述肥胖治疗新靶点(PZP、GRP78、UCP1、NF-κB、BMAL1、IL-17A、PPARγ)相关产品,可助力广大科研工作者进行代谢紊乱疾病治疗相关研究。
参考文献
[1] Lin J, Jiang X, Dong M, et al. Hepatokine Pregnancy Zone Protein Governs the Diet-Induced Thermogenesis Through Activating Brown Adipose Tissue[J]. Adv Sci (Weinh), 2021, Sep 13: e2101991.(IF=16.806)
[2] Maury E, Navez B, Brichard SM. Circadian clock dysfunction in human omental fat links obesity to metabolic inflammation[J]. Nat Commun, 2021, 12: 2388.(IF=14.919)
[3] Yu F, Wang Z, Zhang T, et al. Deficiency of intestinal Bmal1 prevents obesity induced by high-fat feeding[J]. Nat Commun, 2021, 12: 5323.(IF=14.919)
[4] Teijeiro A, Garrido A, Ferre A, et al. Inhibition of the IL-17A axis in adipocytes suppresses diet-induced obesity and metabolic disorders in mice[J]. Nat Metab, 2021, 3(4): 496-512.(IF=13.511)