细胞外囊泡,只知道外泌体?该了解下凋亡小体了
细胞外囊泡(extracellular vesicle,EV)是由细胞释放的各种具有膜结构的囊泡统称。由于其直径和发生方式的不同,分为4个亚群:外泌体(exosomes,直径30~150 nm)、微泡(microvesicles,直径100~1000 nm)、凋亡小体(apoptotic body,直径100~5000 nm)和癌小体(oncosomes,直径1~10μm)。其中外泌体的研究最为成熟,而凋亡小体是细胞凋亡过程中产生的,主要指胞膜皱缩内陷,分割包裹胞质,内含DNA物质及细胞器,形成的泡状小体。细胞凋亡是由基因控制的细胞自主的有序死亡,是多基因严格控制的过程。这些基因在种属间非常保守,如Bcl-2家族、caspase家族、癌基因如C-myc、抑癌基因如p53等。能够诱发细胞凋亡的因素很多,如射线、药物等。
虽然外泌体和凋亡小体囊泡直径及产生方式不同,但它们的研究应用方向类似,主要应用于组织修复、损伤修复、糖尿病、心梗、抗肿瘤等领域。近几年,对凋亡小体的研究热度在逐渐升温。因为与活细胞产生的外泌体相比,凋亡细胞能以更高的效率产生凋亡小体。并且通过标准化操作可以完全控制细胞凋亡过程,但是扩大外泌体的产生就没那么容易了。例如2021年4月16日,《Science Advances》(IF=14.136)上在线发表的题为“Apoptotic body–mediated intercellular delivery for enhanced drug penetration and whole tumor destruction”的文章,该研究首先提出并证明凋亡小体可以在细胞凋亡后将剩余的药物携带到邻近的肿瘤细胞中;2021年5月4日,《Advanced Science》(IF=16.806)发表了题为“Delivering Antisense Oligonucleotides across the Blood-Brain Barrier by Tumor Cell-Derived Small Apoptotic Bodies”的文章,该研究表明脑转移性癌细胞分泌的纳米级凋亡小体,可作为一种能够突破血脑屏障的药物递送载体。


《Science Advances》上发表的研究是通过喜树碱(CPT)、PR104A和二硫键组成了异二聚体前体药物CPT-SS-PR104A,后自组装制备了CSSP NPs(纳米颗粒)。纳米药物进入细胞后,高水平的胞质谷胱甘肽(GSH)会触发二硫键断裂,从而迅速释放CPT和PR104A。CPT诱导细胞凋亡,从而产生了包含有CPT和PR104A的凋亡小体。凋亡小体可以通过邻近效应被邻近细胞吞噬,从而将药物传递到内部缺氧的肿瘤细胞中。PR104A可以被激活以在低氧细胞中发挥细胞毒性,从而进一步渗透药物(图1)。该研究表明,凋亡小体介导的邻近效应可以促进CSSP NPs实现肿瘤渗透,从而消除所有肿瘤细胞亚群。
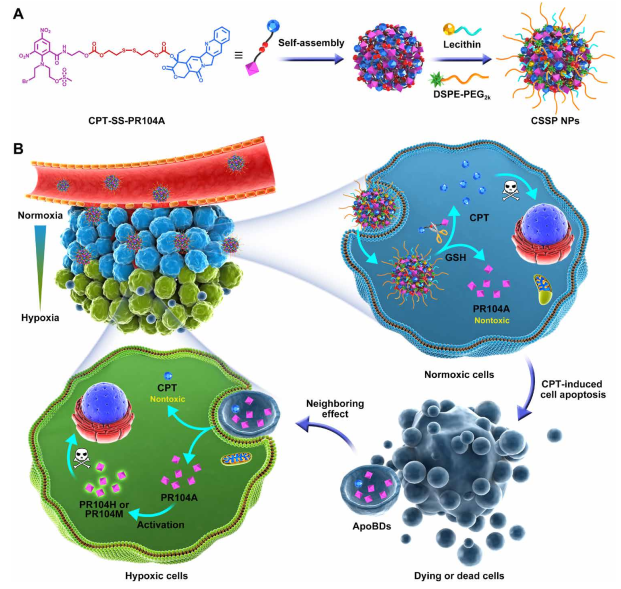
图1. 凋亡小体将药物携带到邻近的肿瘤细胞中的示意图(图片来源于《Science Advances》杂志)
《Advanced Science》中的文章显示研究者选择了有高脑转移能力的细胞系B16F10(小鼠黑色素瘤细胞)来产生凋亡小体。为了提高反义寡核苷酸(ASO)转染到癌细胞中的效率,将TNF-α ASO与阳离子魔芋葡甘聚糖(cKGM)结合形成cKGM/ASO复合物(CKA),这些细胞系能表达甘露糖受体(MR),使得ASO转染效率与Lipofectamine 2000相同。紫外照射后H2O2诱导细胞凋亡。含有cKGM/ASO复合物的凋亡小体被命名为“CABs”。研究者分离了小凋亡小体(<1000 nm),小凋亡小体直径在纳米级,不易被吞噬细胞吞噬,药物装载效率高。 装载ASO的小凋亡小体(sCABs)被脑血管内皮细胞转运,突破了由CD44v6介导的血脑屏障,最终被大脑中的小胶质细胞吸收(图2)。在帕金森病(PD)小鼠模型中,sCABs通过ASO的抗炎作用,极大地改善了小鼠帕金森病的症状。
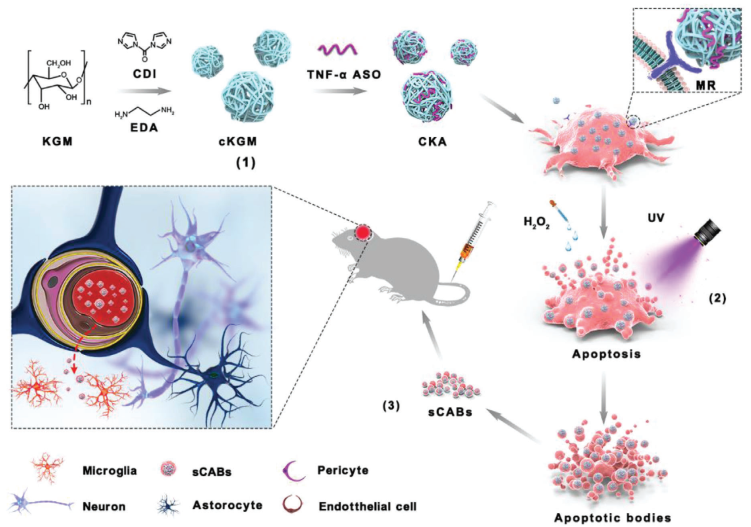
图2. sCABs产生及ASO传送到脑的示意图(图片来源于《Advanced Science》杂志)
云克隆开发了神经系统退行性疾病实验动物模型(如帕金森病实验动物模型),并可提供细胞培养、细胞凋亡、新药实验服务(如药效学、毒理试验)等。
更多信息,欢迎访问http://www.cloud-clone.com/。