肺纤维化发病机制研究新进展
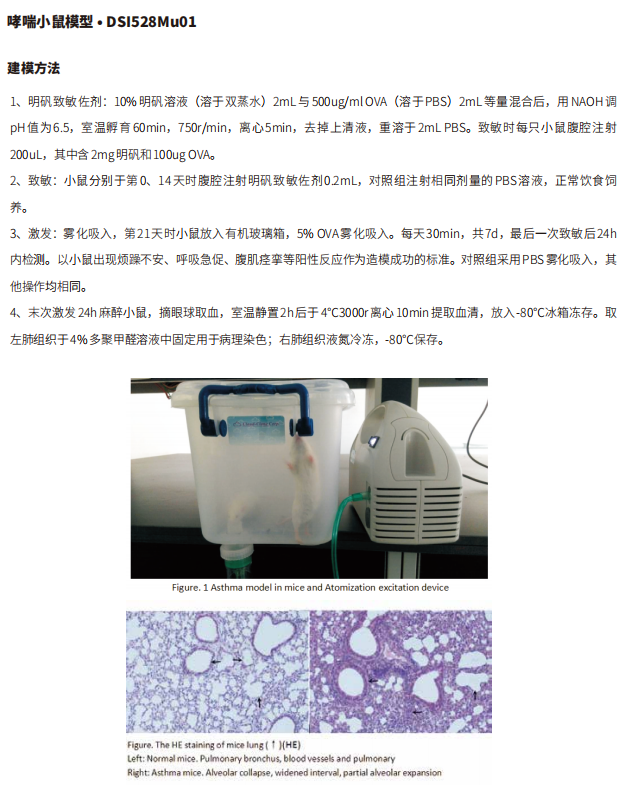
肺纤维化(PF)是成纤维细胞增殖,大量细胞外基质聚集,并伴炎症损伤、组织结构破坏为特征的一大类肺疾病终末期改变,也就是正常的肺泡组织被损坏后,经过异常修复导致的结构异常。绝大部分PF病因不明,称为特发性间质性肺炎。而特发性间质性肺炎中最常见的以PF病变为主要表现形式的疾病类型,为特发性PF,是一种能导致肺功能进行性丧失的间质性肺疾病。
PF发病机制研究新进展
PF患者大都预后不佳。尽管一些抗纤维化治疗药物可显著减少用力肺活量的下降,但这些药物既不能促进恢复,也不能阻止功能下降的进展和缓解PF中的组织结构扭曲。因此,需要更好地了解PF的分子和细胞机制对于发现有效的抗PF药物至关重要。近期,多篇文献报道了PF发病机制的新发现,可作为靶向治疗PF的潜在途径。
1. 趋化因子CCL1触发AMFR-SPRY1通路,驱动PF
趋化因子CCL1通过与其受体相互作用将免疫细胞募集到损伤部位和炎症组织,从而调节组织稳态,在各种人类炎症性疾病中发挥作用。中南大学湘雅第二医院的Zhuo-wei Hu团队报道PF小鼠和人纤维化肺组织的支气管肺泡灌洗液中CCL1升高[1]。此外,CCL1通过与PF患者和小鼠PF模型肺组织中的自分泌运动因子受体 (AMFR) 相互作用将肺成纤维细胞激活为肌成纤维细胞,从而发挥促纤维化作用。从机制上讲,CCL1触发AMFR磷酸化,激活AMFR 的E3连接酶活性及对ERK抑制剂Spry1的泛素化(图1)。这减轻了Spry1对 ERK-p70S6K信号活性的抑制作用并增强了促纤维化蛋白的合成。这些研究结果提示CCL1-AMFR-ERK信号级联作为治疗PF的治疗靶点。
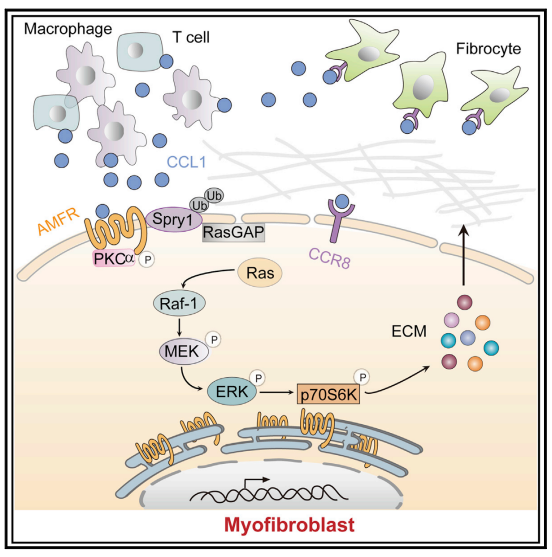
图1. 趋化因子CCL1通过AMFR-SPRY1通路驱动PF
2. TGFβ2 和 TGFβ3 亚型驱动纤维化疾病
转化生长因子-β (TGFβ) 是纤维化的关键驱动因素。哺乳动物中的三种 TGFβ亚型(TGFβ1、 TGFβ2和 TGFβ3)在胚胎发育中具有不同的功能;然而,TGFβ2和TGFβ3 的后天病理作用和激活机制尚未得到很好的印证。美国基因科技公司的Joseph R. Arron团队证明与 TGFβ1 相比,TGFβ2 和 TGFβ3 的潜伏形式可以通过独立于整联蛋白的机制激活,并且具有较低的激活阈值[2]。与健康对照组织相比,TGFβ2和 TGFβ3在PF患者病变组织中的表达增加。用强效变构抗体对 TGFβ2 和 TGFβ3 进行同工型选择性抑制可以改善小鼠体内实验性纤维化(图2)。这些发现支持将同工型选择性TGFβ2和/或TGFβ3抑制作为慢性纤维化疾病患者的治疗策略。

图2. 抗TGFβ2和抗TGFβ3抗体治疗可减少PF模型中的纤维化
3. Cpt1a-Bcl-2 相互作用调节细胞凋亡抵抗和纤维化重塑
线粒体钙单向转运蛋白 (MCU) 调节肺巨噬细胞的代谢重编程和PF的进展。纤维化进展与肺巨噬细胞的凋亡抵抗有关。美国阿拉巴马大学伯明翰分校A. Brent Carter团队发现PF患者和模型小鼠的肺巨噬细胞中线粒体Bcl-2显着增加[3]。而在表达显性抑制MCU的小鼠中,Bcl-2 显着降低。MCU 通过增加 Cpt1a 的表达和活性来调节对脂肪酸 β-氧化的代谢重编程。Cpt1a是脂肪酸β氧化的限速酶,通过与 Bcl-2 的 BH3 结构域结合而直接与 Bcl-2 相互作用,该结构域将 Bcl-2 锚定在线粒体中以减弱细胞凋亡。巨噬细胞中 Bcl-2 的缺失保护小鼠免于发生肺纤维化。此外,在纤维化形成后,当 Bcl-2 被删除或被 ABT-199 抑制时,小鼠纤维化消退(图3)。这些观察结果表明巨噬细胞脂肪酸β氧化、抗凋亡和失调的纤维化重塑之间存在相互作用。

图3. Cpt1a-Bcl-2结合调节细胞凋亡和纤维化重塑
云克隆不仅可提供肺纤维化动物模型,也涵盖其他常见呼吸系统疾病(哮喘、支气管炎、肺栓塞、肺炎、慢性阻塞性肺疾病等)动物模型。还具有各类肺疾病检测指标及上述研究中涉及的蛋白(CCL1、AMFR、ERK、Spry1、TGFβ2、TGFβ3、Bcl-2、Cpt1a),可助力广大科研工作者进行肺疾病相关研究。
参考文献
[1] Liu SS, Liu C, Lv XX, et al. The chemokine CCL1 triggers an AMFR-SPRY1 pathway that promotes differentiation of lung fibroblasts into myofibroblasts and drives pulmonary fibrosis[J]. Immunity, 2021, 54(9): 2042-2056.(IF=31.745)
[2] Sun T, Huang Z, Liang WC, et al. TGFβ2 and TGFβ3 isoforms drive fibrotic disease pathogenesis[J]. Sci Transl Med, 2021, 13(605): eabe0407.(IF=17.956)
[3] Gu L, Surolia R, Larson-Casey JL, et al. Targeting Cpt1a-Bcl-2 interaction modulates apoptosis resistance and fibrotic remodeling[J]. Cell Death Differ, 2021.(IF=15.828)