子宫内膜异位症的非激素治疗新靶点——神经肽S受体1
期刊:SCIENCE TRANSLATIONAL MEDICINE
影响因子:17.956

2021年8月25日,牛津约翰拉德克利夫医院Krina T. Zondervan团队在《Science Translational Medicine》上发表题为“Neuropeptide S receptor 1 is a nonhormonal treatment target in endometriosis”的文章,发现NPSR1/NPS系统与 III/IV 期子宫内膜异位症具有相关性,是一种可用于治疗子宫内膜异位症的非激素靶点。在这篇文章中,云克隆ELISA试剂盒【神经肽S(NPS)检测试剂盒(酶联免疫吸附试验法),CEA796Hu】受到科研工作者的认可,荣登优秀国际期刊。

研究简介:
子宫内膜异位症,即子宫外子宫内膜样组织的生长,是一种常见慢性雌激素依赖性炎症,会导致女性盆腔疼痛和不孕症。目前的治疗选择仅限于去除病变的侵入性外科手术,或可能产生明显副作用的激素治疗。在这项研究中,作者首先在基于人类家庭和人群的研究中使用遗传分析,辅以对患有自发性子宫内膜异位症的恒河猴的研究,以确定神经肽 S (NPS) 受体 1 (NPSR1) 低频常见变体与子宫内膜异位症的相关性,随后进行了 NPSR1 的体外和体内靶标验证和抑制研究,以证明其作为子宫内膜异位症治疗靶标的前景。
首先,基于作者先前证明染色体 7p13-15 与子宫内膜异位症的联系的研究,对 32个家族该区域进行了精细映射非参数连锁分析和单倍型分析,并将区域缩小到由 D7S683 和 D7S510 两侧的 5 Mb 片段。对该片段基因进行测序分析,发现NPSR1 中具有≥1 个低频变异、非同义编码变异的病例较高。进一步分析了所有子宫内膜异位症I/II 期、III/IV 期和家族性 III/IV 期患者与健康对照的NPSR1变异,观察到NPSR1与 III/IV 期子宫内膜异位症存在显著关联。在进行人类研究的同时,作者对具有自发性子宫内膜异位症的多代恒河猴病例和健康对照的 NPSR1 进行了靶向测序,在病例中观察到三种罕见的错义变异,而在对照中未观察到。这些对两个物种的平行遗传分析表明 NPSR1 在子宫内膜异位症的发病机制中发挥作用。
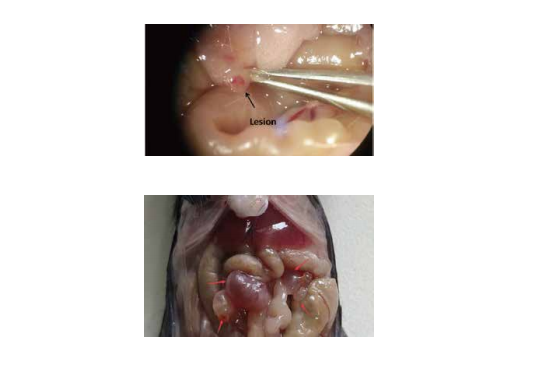
其次,作者测试了子宫内膜组织中以及腹膜液(PF)的免疫细胞中NPSR1 及其同源配体 NPS 的存在。发现NPSR1 在在位和异位子宫内膜的腺上皮细胞中强烈表达。相反,NPS 在基质中表达,但不在腺上皮中表达。PF免疫细胞的流式细胞术分析表明,大多数造血细胞在其表面表达 NPSR1。进一步使用飞行时间质谱法 (CyTOF) 来区分 PF 的 NPSR1 + 白细胞群,在患者中鉴定出在对照组中不存在的NPSR1高度阳性的浸润单核细胞群。
最后,作者使用小分子抑制剂 SHA 68R抑制单核细胞中的 NPSR1 信号并评估对体外 NPS/NPSR1 信号转导的不同阶段的抑制作用。该抑制剂显示出对 NPSR1 受体激活的剂量依赖性抑制。同时,SHA 68R在脂多糖和 NPS 刺激单核细胞后发挥出抑制 TNF-α 释放的能力。作者进一步在子宫内膜异位症炎症模型中研究了体内 NPSR1 抑制的影响。发现 SHA 68R能有效减少浸润单核细胞的数量,炎性细胞因子白细胞介素 4 (IL-4)、IL-12p40 和 IL-17 的血浆浓度显著降低。使用动态负重试验测定并发现 SHA 68R 可有效子宫内膜异位症炎症小鼠模型中与腹痛相关的自发行为。
总之,该研究结果表明 NPSR1/NPS 系统与 III/IV 期子宫内膜异位症治疗相关性较高,可作为治疗子宫内膜异位症的潜在非激素靶点。
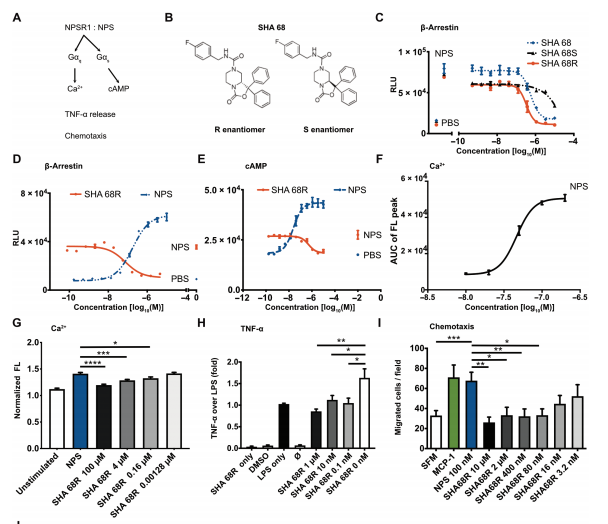
图1. NPSR1特异性抑制剂SHA 68R以剂量依赖的方式减少NPSR1介导的炎症信号
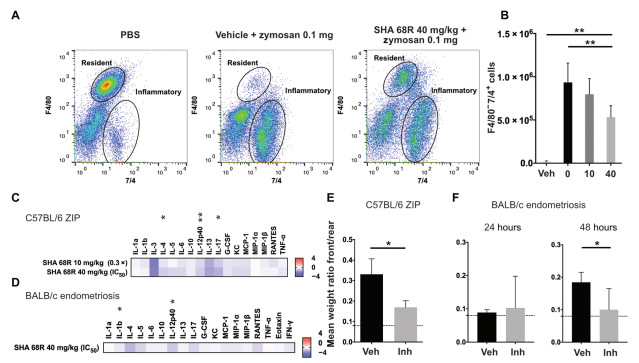
图2. 抑制NPSR1可减轻体内腹膜炎症和腹痛
云克隆可提供相关动物模型
子宫内膜异位症(EM)小鼠模型 • DSI543Mu01
建模方法
1.随机取小鼠一只作为捐赠鼠,脱颈椎法处死,仰卧位固定于手术台,腹部酒精消毒后,沿正中线剖开腹腔。找到Y形子宫,小心分别牵出左、右侧子宫,细心分离双侧子宫系膜。
2.离断宫角与卵巢,在Y形子宫分叉分别剪断左侧及右侧子宫,放入装有生理盐水的无菌弯盘中,反复漂洗子宫表面的血迹,进一步分离剩余粘附的子宫系膜。将两个子宫角分别放置于两个无菌弯盘中,将它们直接剪成大小均等约1mm×1mm的碎片,并将它们悬浮于生理盐水中。
3.将捐赠鼠的子宫按1/2的比例种植于接受鼠腹腔,1只捐赠鼠内膜供应2只接受鼠,用生理盐水悬浮弯盘里的组织碎片。
4.随机取一只小鼠作为接受鼠,取脐下偏正中线处的左下腹为进针点,将溶有子宫组织碎片的生理盐水用号针头连同子宫组织块碎片注入接受鼠的腹腔,后放置于鼠笼。