BRD4蛋白研究新发现——助力治疗包括癌症在内的多种疾病
BRD4 是一种转录和表观遗传调节因子,在胚胎发生和癌症发展过程中起着关键作用。作为溴结构域和末端外结构域 (BET) 家族的成员,BRD4 的特征在于具有两个串联溴结构域(BD1、BD2)。BDs 结合靶蛋白(包括组蛋白)上的乙酰化赖氨酸残基,因而对具有多个乙酰化残基的蛋白质的亲和力更高。BRD4与染色质上的超乙酰化组蛋白区域相互作用,在转录活性调控元件上积累并在起始和延伸步骤中促进基因转录。
BRD4与癌症
神经母细胞瘤(NB)是一种具有快速进展和高死亡率的实体恶性肿瘤,占儿科人群肿瘤相关死亡的 15% 以上,而其潜在的机制和治疗方法仍然难以捉摸。近期,华中科技大学Qiangsong Tong团队于《Molecular Cancer》上发表的文章报道在NB细胞中鉴定了一种新的CUT 样同源框1蛋白 (p113)[1]。p113 与 Zuotin 相关因子 1 (ZRF1) 和BRD4相互作用形成转录调控复合物,并介导 ZRF1/BRD4 的反式激活以上调脂肪醛转化为脂肪酸、脂肪酸 β-氧化和线粒体复合物 I 活性必需的 ALDH3A1、NDUFA1 和 NDUFAF5。阻断 p113-ZRF1的相互作用可抑制 NB 细胞的肿瘤发生和侵袭性(图1)。揭示p113/ZRF1/BRD4 轴可作为 NB 进展的潜在治疗靶点。基于BRD4在癌症发展过程中发挥关键作用,癌症治疗的 BET 抑制剂的开发成为热点。然而,BET 抑制剂耐药性经常出现在各种癌症类型中。中山大学附属第六医院的Xiao-Jian Wu团队和新加坡基因组研究所的Qiang Yu团队在《Nature Communications》上联合发表的文章报道在结直肠癌中癌症相关的成纤维细胞激活的基质信号诱导 BRD4 磷酸化,导致 BRD4 稳定[2]。BRD4的磷酸化也显示出与染色质的结合增加,与 BET 抑制剂的结合减少,导致对 BET 抑制剂的抗性(图2)。进一步研究表明,BRD4 磷酸化促进与 STAT3 的相互作用,通过同时结合增强子和超级增强子来诱导染色质重塑,支持促进肿瘤的转录程序。该研究揭示BRD4激活和BET抑制剂耐药性的机制,为制定更有效治疗癌症的策略提供基本原理。
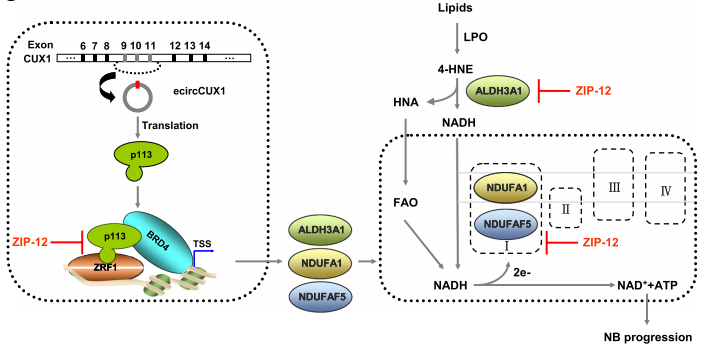
图1. p113、ZRF1、BRD4相互作用激活靶基因示意图
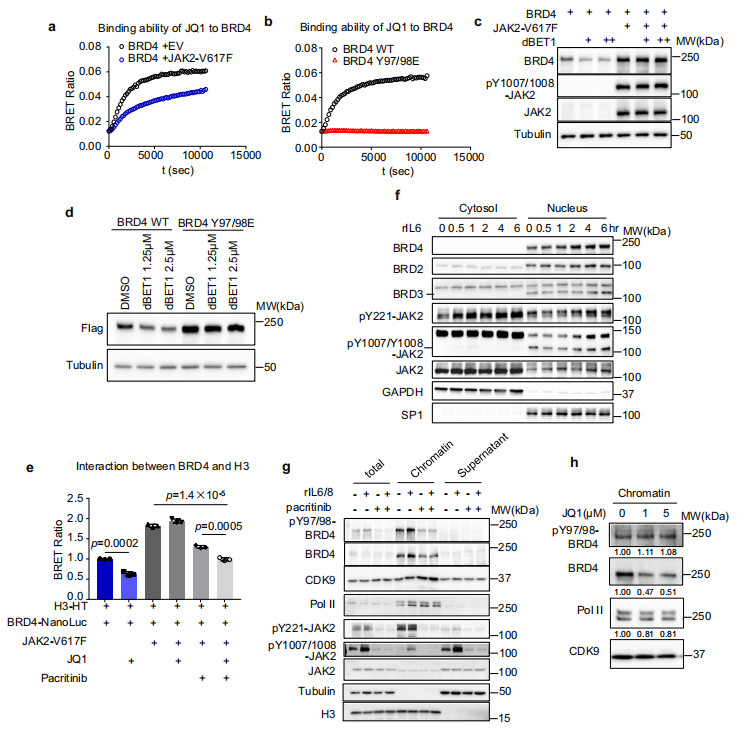
图2. BRD4的磷酸化调节其与染色质和BET抑制剂的结合
BRD4与神经嵴分化
神经嵴对几种外胚层和中胚层组织的发育至关重要。神经嵴分化受损通常会导致心脏流出道形态发生缺陷、腭裂和颅面异常。因此,确定神经嵴分化背后的基因调控网络和分子决定因素将有助于了解神经嵴和相关疾病。2021年10月,美国宾夕法尼亚大学Rajan Jain团队发表于《Nature Genetics》上的文章发现BRD4在基因组折叠中的作用,并利用它来了解基因组折叠在神经嵴祖细胞分化中的重要性[3]。神经嵴中的BRD4缺失导致黏连蛋白病样表型。BRD4 与 NIPBL(一种粘连蛋白激动剂)相互作用,BRD4 耗尽或 BRD4-NIPBL 相互作用的丧失会降低 NIPBL 的占有率,进而会导致基因组折叠和环挤出受损,阻碍神经嵴分化为平滑肌(图3)。总的来说,这些数据揭示BRD4编排基因组折叠并说明平衡黏连蛋白活性与神经嵴分化的相关性。
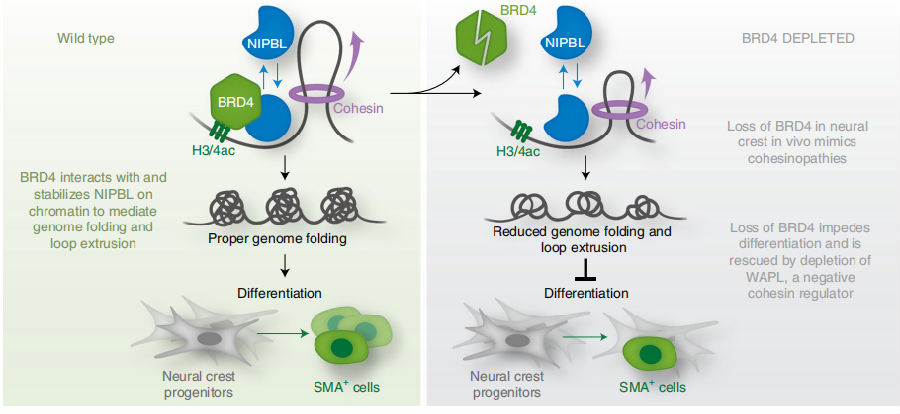
图3. BRD4稳定NIPBL在染色质上的作用机制,以维持染色质相互作用和环挤出示意图
BRD4 与CD8 T 细胞分化
为应对感染,病原体特异性CD8 T细胞分化为功能多样的效应和记忆T细胞群,这对于解决疾病和提供持久的免疫力至关重要。加州大学圣地亚哥分校Ananda W. Goldrath团队发表于《Journal of Experimental Medicine》上的文章揭示BRD4 在感染期间对效应CD8 T细胞分化和维持的重要作用[4]。BRD4可结合对效应T细胞分化至关重要的多种调控区域,并在体内控制末端效应特异性超增强子的转录活性(图4)。诱导的BRD4缺失或小分子介导的BET抑制会损害末端效应T细胞表型的维持。BRD4 也是小鼠模型肿瘤微环境中CD8 T细胞终末分化所必需的,表明其对免疫疗法有影响。这些数据揭示了BRD4 在协调顺式调节元件的活性以控制 CD8 T 细胞命运和谱系稳定性方面的作用,有望为控制感染和恶性肿瘤的疫苗接种或免疫治疗方法提供希望。
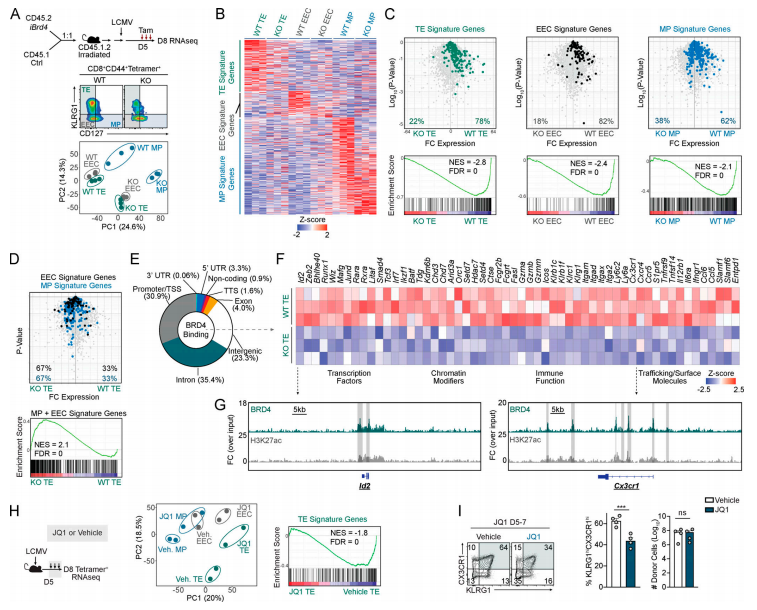
图4. BRD4结合指定基因协调效应CD8 T细胞分化
参考文献
[1]Yang F, Hu A, Guo Y, et al. p113 isoform encoded by CUX1 circular RNA drives tumor progression via facilitating ZRF1/BRD4 transactivation[J]. Mol Cancer, 2021, 20(1): 123.(IF=27.401)
[2]Wang W, Tang YA, Xiao Q, et al. Stromal induction of BRD4 phosphorylation Results in Chromatin Remodeling and BET inhibitor Resistance in Colorectal Cancer[J]. Nat Commun, 2021, 12(1): 4441.(IF=14.919)
[3]Linares-Saldana R, Kim W, Bolar NA, et al. BRD4 orchestrates genome folding to promote neural crest differentiation[J]. Nat Genet, 2021, 53(10): 1480-1492.(IF=38.330)
[4]Milner JJ, Toma C, Quon S, et al. Bromodomain protein BRD4 directs and sustains CD8 T cell differentiation during infection[J]. J Exp Med, 2021, 218(8):e20202512.(IF=14.307)
云克隆不仅可提供相关实验动物模型,如多种肿瘤实验动物模型、腹腔感染模型等,还开发了BRD4蛋白及疾病检测指标相关产品,可助力广大科研工作者进行BRD4蛋白功能相关研究。

