为何外泌体相关研究能持续热门?——外泌体与肿瘤的关系
在各种细胞外囊泡中,外泌体(exosomes)的研究最为成熟,外泌体的形成过程:细胞质膜内陷,细胞外成分和细胞膜蛋白被包裹在一起,形成早期内涵体(early endosome),这些早期内涵体可以与其他细胞器发生物质交换,或者不同早期内涵体之间融合形成晚期内涵体,晚期内涵体膜内陷进一步形成细胞内多膜体(Multivesicular bodies,MVBs),细胞内多膜体与细胞膜融合后释放到胞外基质中形成外泌体(见图1)。
多种细胞在正常及病理状态下均可分泌外泌体,包括内皮细胞、免疫细胞、平滑肌细胞等,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁等,参与细胞间的通讯。
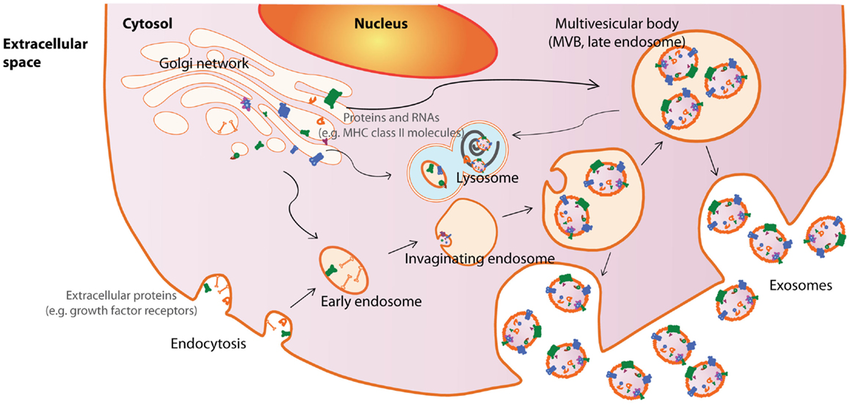
图1. 外泌体的形成过程(图片来源于《Frontiers in Immunology》杂志)
外泌体介导的细胞间通讯主要通过三种方式:一、外泌体膜蛋白可以与靶细胞膜蛋白结合,进而激活靶细胞内的信号通路。二、在细胞外基质中,外泌体膜蛋白可以被蛋白酶剪切,剪切的碎片可以作为配体与细胞膜上的受体结合,从而激活细胞内的信号通路。三、外泌体膜可以与靶细胞膜直接融合,非选择性的释放其内含物。
自1983年初次发现后,研究者们对外泌体的认识逐步加深,从细胞排泄废物的方式,到可携带RNA(mRNA、microRNA、lncRNA)进入细胞,并靶向调节细胞中mRNA水平的小囊泡,再到携带多种蛋白(细胞质蛋白,如RAB4、RAB5等;信号转导因子,如ARF1、CDC42等;代谢酶,如PKM2、PGK1等;跨膜蛋白,如CD63、CD81等),参与机体免疫应答、细胞迁移与分化、肿瘤转移等生命活动,不同细胞来源的外泌体还含有细胞种属特异性的生物分子,具有不同的功能。外泌体目前主要应用于组织修复、损伤修复、糖尿病、心梗、抗肿瘤、抗衰老等领域。
本文主要介绍外泌体和肿瘤的关系。研究发现,在许多的肿瘤细胞中都发现了外泌体的释放,包括卵巢癌、乳腺癌、前列腺癌、结直肠癌等。此外,相较于正常细胞,肿瘤细胞往往能释放更多的外泌体,其中一个原因是肿瘤细胞周围低pH微环境可诱导大量释放外泌体。
外泌体可促进肿瘤细胞增殖,其中一种方式是肿瘤细胞分泌外泌体,外泌体通过体液进入不同的组织,将细胞中的致癌因子转移到受体细胞,使受体细胞癌变(见图2)。不仅如此,外泌体还可以通过与癌细胞融合,调动肿瘤细胞的信号通路,促进癌细胞转移。肿瘤来源的外泌体还可以改变血管通透性,促使肿瘤转移扩散。如肝癌细胞来源的miR-103可通过外泌体传递到内皮细胞,抑制连环蛋白等的表达,减弱内皮细胞连接的完整性,诱导血管渗漏,促进肿瘤转移。外泌体还能帮助癌细胞逃离免疫系统的清除,如外泌体能诱导免疫细胞凋亡(前列腺癌和黑色素瘤来源的外泌体中的Fas配体可诱导T淋巴细胞凋亡)。肿瘤细胞分泌的外泌体还会增加肿瘤的耐药性,因为肿瘤细胞可以通过向外分泌外泌体的方式排出化疗药物,从而增强其对化疗药物的抵抗力。
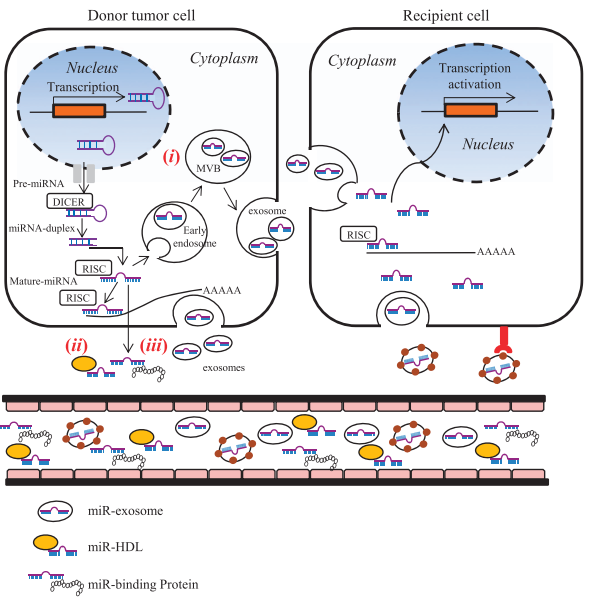
图2. 外泌体促进肿瘤增殖的模式图(图片来源于《Experimental & Molecular Medicine》杂志)
因为外泌体跟肿瘤细胞紧密关联,使其成为了抗肿瘤中举足轻重的一份子。外泌体中的蛋白和核酸标志物可用于癌症诊断,如外泌体Fibronectin和EDIL3用于乳腺癌早期诊断;外泌体Claudin4是卵巢癌早期诊断标志物;外泌体Survivin可用于前列腺癌的早期诊断,且比传统血液PSA蛋白检测更精确;外泌体中的miR-21,miR-1246可作为乳腺癌检测的标志物;来源于血清的外泌体中的非编码RNA分子RNU6-1可应用于诊断多形性成胶质细胞瘤。
此外,抑制肿瘤细胞分泌外泌体也是一种抗癌手段,如神经磷脂酶2有利于肿瘤外泌体的合成,静脉注射神经磷脂酶2的抑制剂GW4869可以有效抑制载瘤小鼠分泌肿瘤外泌体,降低肿瘤的转移率。外泌体还可作为癌症治疗药物的载体,通过血液等体液的运输和传递,实现药物对癌症的靶向治疗。因为外泌体体积小,能穿过血脑屏障,且免疫反应程度低,免疫系统难识别。如研发人员开发了可运送紫杉醇的外泌体,用于靶向抗癌治疗,在治疗小鼠癌症时,其剂量比常规治疗低50倍,并且未引起免疫反应。还可以利用外泌体破坏肿瘤生长的微环境从而影响肿瘤的生长,如经姜黄素预处理的乳腺癌外泌体可以影响组织中被抑制的自然杀伤细胞活性,重启机体免疫系统。
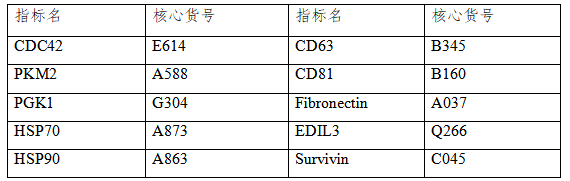
对外泌体的研究仍在不断深入,云克隆开发了外泌体相关蛋白的产品以助力科学研究,部分指标节选如下,供参考。
更多信息,欢迎访问http://www.cloud-clone.com/。