帕金森疾病研究新进展
帕金森病 (PD) 是第二常见的神经退行性疾病,影响着数百万人。PD的主要运动特征包括运动迟缓、僵硬和静止性震颤。这些运动体征通常先于非运动表现,例如嗅觉功能障碍、快速眼动睡眠行为障碍、抑郁和便秘。 此外,在疾病过程中,多达 80% 的患者会出现认知障碍并发展为痴呆。
帕金森疾病研究新进展
PD 的主要运动症状是由于黑质中多巴胺能神经元的丢失引起的,这些神经元调节习惯性和目标导向运动的基底神经节回路。PD 的发病机制无疑是多因素的。各种细胞功能障碍,包括多巴胺代谢改变、氧化应激增加、线粒体衰竭、钙稳态改变、神经炎症、自噬受损和蛋白酶体功能障碍似乎与 PD 相关的神经元丢失密切相关。此外,大量证据表明错误折叠蛋白的细胞内积累,尤其是 SNCA/α-突触核蛋白和内质网超载可能导致这种病理。
1. 线粒体复合物 I 的破坏诱导进行性PD
黑质多巴胺能神经元中功能性线粒体复合物 I (MCI) 的丧失是PD的标志。美国西北大学范伯格医学院神经科学系 D. James Surmeier团队使用交叉基因组学在多巴胺能神经元中删除了编码 MCI 催化核心的基本亚基 Ndufs2 的基因[1]。MCI 的破坏引起了新陈代谢的 Warburg 样转变,使神经元存活,但引发了多巴胺能表型的进行性丧失,并首先在黑质纹状体轴突中显现。这种轴突缺陷伴随着运动学习和精细运动缺陷,但没有明显的左旋多巴反应性PD,这种症状只在黑质释放多巴胺丧失后出现(图1)。因此,仅 MCI 功能障碍就足以导致进行性类人PD,其中黑质多巴胺释放的丧失对运动功能障碍产生了关键影响,这与当前的PD范式相反。
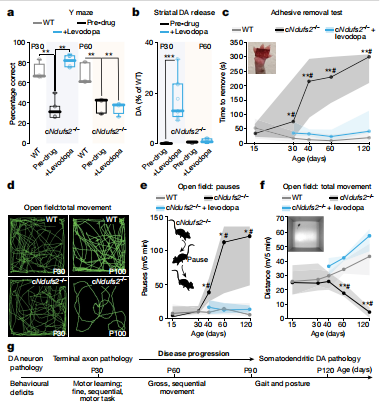
图1. Ndufs2−/−小鼠出现进展性左旋多巴反应性PD
2. LRP10与SORL1在细胞内囊泡追踪通路中相互作用,并在PD疾病进展中发挥作用
低密度脂蛋白受体相关蛋白 10 (LRP10) 基因的功能丧失变异体与常染色体显性PD和痴呆相关。为了更好地了解 LRP10 变体如何导致神经退行性变,荷兰鹿特丹大学医学中心 Wim Mandemakers团队首先对死后大脑和人类诱导的多能干细胞 (iPSC) 衍生的星形胶质细胞和神经元中的 LRP10 表达进行了深入表征[2]。在大脑和iPSC 衍生的细胞中,LRP10 主要在星形胶质细胞中高度表达,但在神经元中无法观察到。在星形胶质细胞中,LRP10 存在于跨高尔基网络、质膜、逆转录酶和早期内体中,也部分地与 sortilin 相关受体 1 (SORL1) 共定位并相互作用(图2)。此外,在携带LRP10突变体的患者中检测到明显增大的LRP10阳性囊泡。进一步发现 LRP10 阳性囊泡是 PD 大脑黑质中成熟路易体的核心。非神经元细胞中的高 LRP10 表达和神经元中无法检测到的LRP10水平表明 LRP10 介导的致病性是通过细胞非自主机制启动的,可能涉及 LRP10 与 SORL1 在囊泡运输途径中的相互作用。

图2. LRP10定位于囊泡结构,并与SORL1相互作用
3. XBP1s 和 PINK1 之间功能相互作用控制线粒体自噬并可能影响PD
受PD影响的大脑显示出一致的内质网应激和线粒体功能障碍。XBP1 是一种转录因子,在内质网应激下激活被核酸酶 ERN1/IREα 非常规剪接后而产生,而 PINK1 是一种激酶,被认为是线粒体生理学的传感器和线粒体自噬过程的主要守门人。法国蔚蓝海岸大学Cristine Alves da Costa团队发现 XBP1s 在人类细胞、原代培养的神经元和小鼠大脑中反式激活 PINK1,并触发了完全依赖于内源性 PINK1 的前线粒体自噬表型[3]。他们还揭示了 XBP1s 的 PINK1 依赖性磷酸化,该磷酸化调节其核定位,从而控制其转录活性(图3)。PINK1 诱导的 XBP1s 磷酸化发生在与受PD影响大脑黑质中磷酸化的残基相似且相关的残基处。这些数据证明XBP1s 转录因子在控制线粒体自噬中的直接作用以及控制线粒体自噬的功能性 XBP1s-PINK1 环的发生,该环可能在PD病理条件下被破坏。
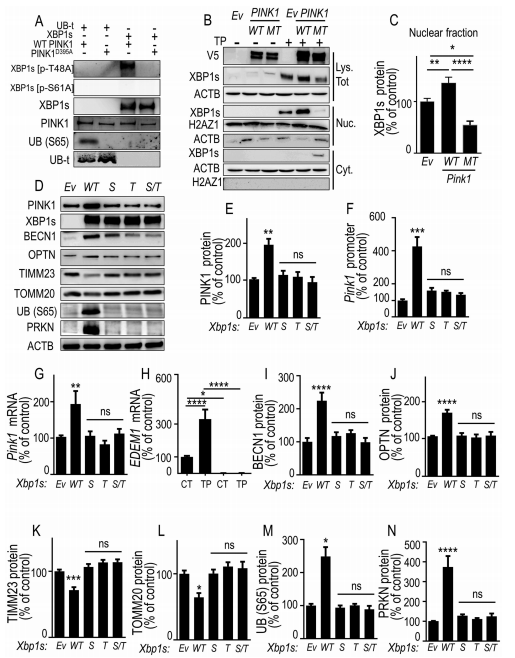
图3. PINK1 介导的 XBP1s 磷酸化增强了其核转位,控制其自身的转录和线粒体自噬
参考文献
[1] González-Rodríguez P, Zampese E, Stout KA, et al. Disruption of mitochondrial complex I induces progressive parkinsonism [J]. Nature. 2021;599(7886):650-656. (IF=49.962)
[2] Grochowska MM, Carreras Mascaro A, Boumeester V, et al. LRP10 interacts with SORL1 in the intracellular vesicle trafficking pathway in non-neuronal brain cells and localises to Lewy bodies in Parkinson's disease and dementia with Lewy bodies [J]. Acta Neuropathol. 2021;142(1):117-137.(IF=17.088)
[3] El Manaa W, Duplan E, Goiran T, et al. Transcription- and phosphorylation-dependent control of a functional interplay between XBP1s and PINK1 governs mitophagy and potentially impacts Parkinson disease pathophysiology. Autophagy. 2021;17(12):4363-4385.(IF=16.016)
云克隆不仅可提供多种神经系统疾病动物模型,包括帕金森、阿尔兹海默症、焦虑症、慢性应激抑郁等,涵盖常见神经系统疾病。还具有各类神经系统疾病检测指标相关产品,可助力广大科研工作者进行神经系统疾病相关研究。

