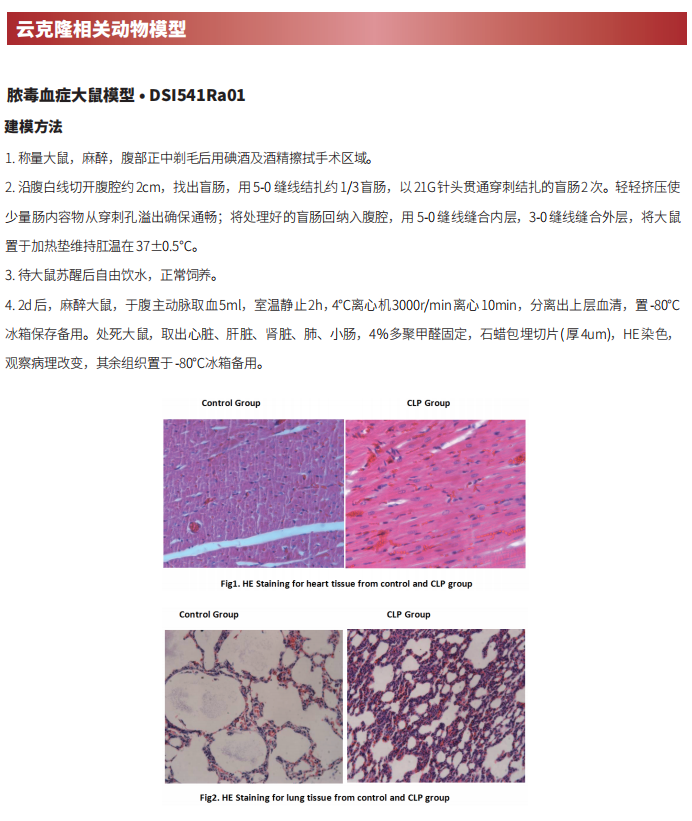
脓毒症疾病机理研究新发现
脓毒症是一种复杂的异质疾病,由感染性损伤引起的炎症反应失调导致,诱导器官功能障碍,免疫功能反应受损,导致继发感染和不良后果的风险增加。流行病学数据表明,脓毒症是一个严重的公共卫生问题,在全世界有着高发病率和高死亡率,而且这种趋势逐年增加。
脓毒症疾病机理研究新发现
目前,脓毒症的经典治疗依赖于适当的抗生素和类固醇激素尽快根除感染源,这对于脓毒症的良好预后至关重要。然而,由于抗生素治疗的不利后果,例如耐药性和不良反应,抗生素的确切益处可能存在争议。此外,许多关于免疫调节脓毒症的临床试验未能改善患者的预后。因此,需要对脓毒症的疾病机理有更深入的了解,以制定更好的策略来改善脓毒症患者的预后。
1.APOL1风险变异导致内皮细胞缺陷加剧脓毒症
宾夕法尼亚大学佩雷尔曼医学院KatalinSusztak团队发现非洲血统的个体脓毒症的发病率和严重程度高于欧洲血统[1]。进一步分析显示,存在于非洲血统个体中的锥虫分解因子载脂蛋白L1(APOL1)中的遗传风险变异(RV)与脓毒症发病率和严重程度增加有关。对具有RVAPOL1内皮特异性表达的小鼠的分析和体外研究表明,RVAPOL1干扰线粒体自噬,导致线粒体DNA的细胞溶质释放以及炎症小体(NLRP3)和细胞溶质核苷酸传感途径(STING)的激活(图1)。NLRP3和STING的基因缺失或药理学抑制保护小鼠免受RVAPOL1诱导的脓毒症中渗透性缺陷和促炎性内皮细胞变化的影响。这一研究确定内皮RVAPOL1在脓毒症中的作用,强调了线粒体功能障碍和炎症小体和STING激活的关键作用,可作为干预脓毒症的潜在治疗靶点。

图1RVAPOL1导致内皮细胞缺陷,激活NLRP3炎症小体和STING加剧脓毒症
2.血小板MHCI类在脓毒症期间介导CD8+T细胞抑制
在脓毒症中,血小板-白细胞相互作用增加,并且与不良临床事件相关。美国犹他大学分子医学项目MatthewT.Rondina团队通过主要组织相容性复合物I类(MHC-I)系统地评估了血小板抗原内化和呈递及其对体内和体外脓毒症中抗原特异性CD8+T细胞的影响[2]。他们发现在脓毒症期间的人类和小鼠血小板中MHC-I的表达显著增加。脓毒症期间血小板MHC-I的上调增加了抗原交叉呈递以及以抗原特异性方式与CD8+T细胞的相互作用。利用血小板谱系特异性MHC-I缺陷小鼠,研究人员发现血小板MHC-I在体外调节抗原特异性CD8+T细胞增殖,以及在脓毒症期间体内CD8+T细胞的数量和功能反应(图2)。在抗原特异性环境中,血小板MHC-I的缺失降低了小鼠败血症相关死亡率。这项研究的结果表明,通过MHC-I,血小板内化、加工和呈递抗原给CD8+T细胞。通过这种机制,脓毒症期间血小板上的MHC-I增加导致CD8+T细胞数量、增殖和功能反应受到抑制。

图2脓毒症小鼠血小板在体外直接诱导抗原特异性CD8+T细胞抑制
3.脓毒症扩大CD39+浆母细胞群体,通过腺苷介导的巨噬细胞抗菌活性抑制促进免疫抑制
脓毒症导致循环中腺苷升高。细胞外腺苷通过A2a受体(A2aR)触发免疫抑制信号传导。脓毒症幸存者会出现持续的免疫抑制,并增加复发感染的风险。巴西圣保罗大学Jose´CarlosAlves-Filho团队利用盲肠结扎和穿刺模型对脓毒症及继发感染进行研究,以评估腺苷在脓毒症后免疫抑制中的作用[3]。A2aR缺陷小鼠对脓毒症后继发感染的抵抗力有所提高。脓毒症扩大了CD39hiB细胞的一个子集并升高了细胞外腺苷,这在缺乏表达CD39的B细胞的小鼠中不存在。脓毒症存活的B细胞缺陷小鼠对继发感染的抵抗力更强。从机制上讲,脓毒症B细胞的代谢重编程增加了ATP的产生,ATP被浆母细胞上的CD39转化为腺苷。腺苷信号通路通过A2aR削弱巨噬细胞的杀菌活性和增强白细胞介素-10的产生(图3)。这些结果揭示了CD39+浆母细胞的抑制功能,通过产生大量细胞外腺苷,在脓毒症幸存者中介导长期免疫抑制。
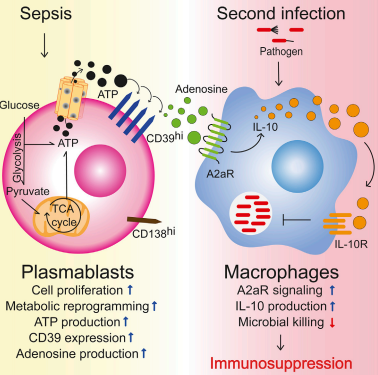
图3脓毒症扩大CD39+浆母细胞群体,通过腺苷介导的巨噬细胞抗菌活性抑制促进免疫抑制
4.IL-6信号和LC3相关吞噬作用的解偶联驱动脓毒症期间的免疫麻痹
吞噬细胞的免疫失活是脓毒症发病机制中的核心事件。希腊克里特岛大学医学院GeorgiosChamilos团队确定IL-6信号传导对LC3相关吞噬作用(LAP)的主要调节作用,并揭示在脓毒症期间这两个过程的解偶联会诱导单核细胞/巨噬细胞的免疫麻痹[4]。在脓毒症中,IL-6信号传导的丧失特异性地消除了微管介导的ERK运输,导致LAP的激活缺陷和单核细胞/巨噬细胞对细菌和真菌病原体的杀伤受损,这可以通过补充IL-6选择性地恢复。这一研究结果将IL-6信号转导与LAP联系起来,在脓毒症免疫麻痹的发展中发挥重要作用(图4),可以将其作为治疗靶点进行探索。
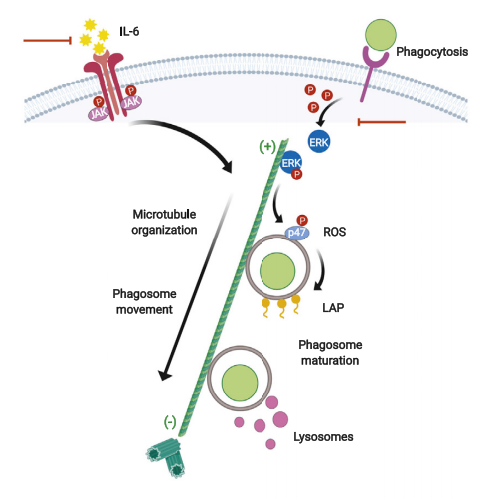
图4IL-6信号和LC3相关吞噬作用的解偶联驱动脓毒症期间的免疫麻痹
参考文献
[1]Wu J, Ma Z, Raman A, et al. APOL1 risk variants in individuals of African genetic ancestry drive endothelial cell defects that exacerbate sepsis [J]. Immunity. 2021, 54(11):2632-2649.e6. (IF=31.745)
[2]Guo L, Shen S, Rowley JW, et al. Platelet MHC class I mediates CD8+ T-cell suppression during sepsis [J]. Blood. 2021, 138(5):401-416. (IF=22.113)
[3]Nascimento DC, Viacava PR, Ferreira RG, et al. Sepsis expands a CD39+ plasmablast population that promotes immunosuppression via adenosine-mediated inhibition of macrophage antimicrobial activity [J]. Immunity. 2021, 54(9):2024-2041.e8. (IF=31.745)
[4]Akoumianaki T, Vaporidi K, Diamantaki E, et al. Uncoupling of IL-6 signaling and LC3-associated phagocytosis drives immunoparalysis during sepsis [J]. Cell Host Microbe. 2021;29(8):1277-1293.e6. (IF=21.023)
云克隆不仅可提供脓毒症动物疾病模型,还具有各类感染免疫相关蛋白指标检测产品以及上述APOL1、NLRP3、STING、MHC-I、A2aR、IL-6等蛋白相关产品,可助力广大科研工作者进行脓毒症相关研究。