这类遗传疾病的病因找到了,竟然是这样的
蛋白酶体相关自身炎症综合征 (PRAAS) 是一种单基因疾病,患者表现为患有严重的炎症性疾病,包括关节挛缩、肌肉萎缩、小细胞性贫血、慢性非典型中性粒细胞性皮肤病伴脂肪营养不良和温度升高。与目前已知的由白细胞介素IL-1介导的自身炎症性疾病相比,PRAAS的基因突变会导致蛋白酶体功能障碍、Ⅰ型干扰素(IFN)持续产生,且对IL-1抑制剂的治疗无反应。2022年2月,Science子刊Science Immunology杂志上发表了一篇题为“Protein kinase R is an innate immune sensor of proteotoxic stress via accumulation of cytoplasmic IL-24”的文章,该文章揭示了蛋白激酶R是一种先天免疫传感器,通过细胞质中IL-24的积累来介导蛋白毒性应激。

研究者利用CRISPR-Cas9介导THP-1细胞免疫蛋白酶体亚基iβ5和iβ1的基因缺失,在体外建立了PRAAS细胞模型。然后,研究者使用ELISA检测多个细胞株的CXCL10和IFN-β含量,发现这些PRAAS模型细胞株表现出与PRAAS患者类似的炎症反应,其转录和IFN-β分泌增加。通过流式细胞术观察到在单细胞水平上IFN-β蛋白水平升高。通过qPCR检测,使用广谱去泛素化酶(DUB)抑制剂PR619后,炎症基因的表达与细胞系的炎症表型相一致。这是由于靶向蛋白酶体降解的泛素化物质的积累,广谱去泛素酶 (DUB) 抑制剂 PR619 增加了这种蛋白质毒性应激和由此产生的炎症基因表达。(见图1)
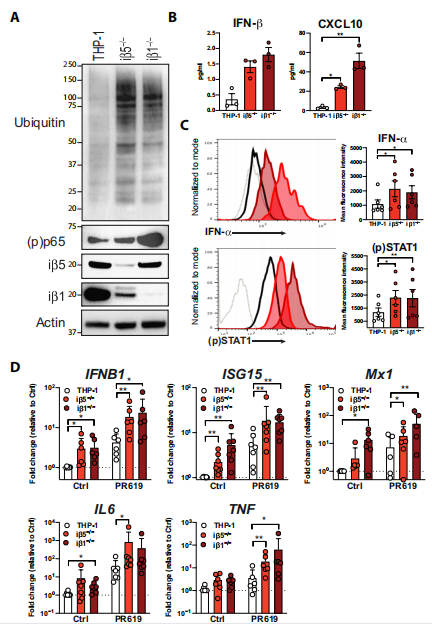
图1 CRISPR-Cas9 介导的 iβ5 或 iβ1 缺失的细胞系
(图片来源于《Science Immunology》杂志)
蛋白激酶R(PKR) 通过肿瘤坏死因子 (TNF) 受体相关因子 3 (TRAF3) 和TRAF2 和 TRAF5 的直接相互作用激活 NF-κβ 来驱动 IFN-αβ 的诱导。研究者发现用cGAMP刺激STING信号通路可诱导IFNB1的转录,使IFNB1的转录水平在亲本THP-1细胞和PKR缺失的THP-1细胞中相似,说明由于 PKR 缺陷导致 IFNB1 基因诱导缺失对蛋白酶体抑制具有特异性。通过免疫印迹观察到PRAAS细胞系中PKR基因缺失导致STAT1磷酸化缺失,炎症基因表达减弱。使用特异性抑制剂 C16 对 PKR 进行化学抑制,发现 iβ5-/- 细胞中炎症基因的表达得到抑制。此外,研究者还研究了PKR缺陷小鼠(PKR−/−)和它们的同窝对照小鼠(PKR+/+),发现硼替佐米可诱导PKR+/+血液和脾脏中Ifnb1, Ifna4, Il6, 和Usp18 mRNA的表达上调;然而,PKR−/−缺失减弱了血液和脾脏中的炎症基因转录。这些数据表明,PKR 在体外和体内都是蛋白酶体抑制下游炎症的先天免疫传感器。(见图2)
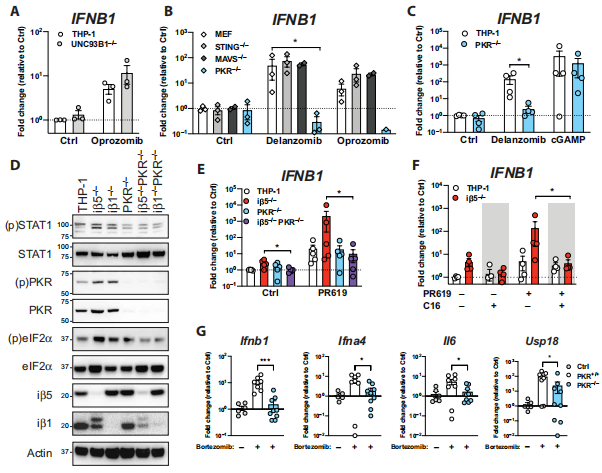
图2 炎症基因表达对PKR 具有依赖性
(图片来源于《Science Immunology》杂志)
研究者利用CRISPR-Cas9基因编辑产生IL-24缺失的细胞,并发现IL-24是蛋白酶体抑制剂地兰佐米诱导炎症反应的唯一候选药物。通过qPCR检测,发现poly(dA:dT)刺激cGAS信号通路诱导IFNB1转录的程度与亲本THP-1细胞中观察到的相同。从免疫印迹的结果来看,在IL-24缺失的iβ5−/−和iβ1−/−细胞株中PKR的激活减少。研究者给对照组小鼠或IL-24−/−小鼠注射硼替佐米,在对照组小鼠中,eIF2α和STAT1的磷酸化发生在PKR的下游,但在IL-24−/−小鼠中不存在。这些数据表明,在体内和体外IL-24驱动PKR依赖的炎症反应。为了确定蛋白酶体功能障碍条件下PKR和IL-24是否相互作用,研究者在iβ5−/−THP-1细胞和对照组中进行了PKR的免疫沉淀,发现IL-24与PKR联合免疫沉淀只发生在蛋白酶体被破坏时。在IL-24-Halo低、稳定表达的U2OS细胞中,研究者发现在蛋白酶体受到抑制的情况下,IL-24在细胞质中积累。(见图3)
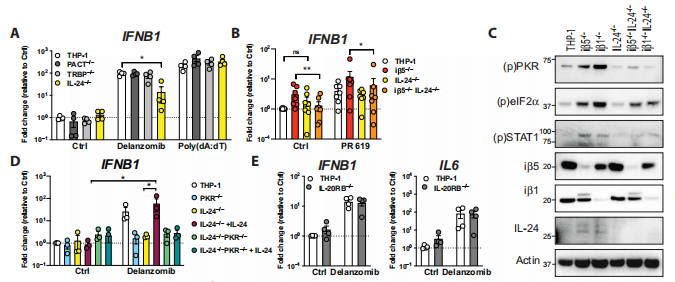
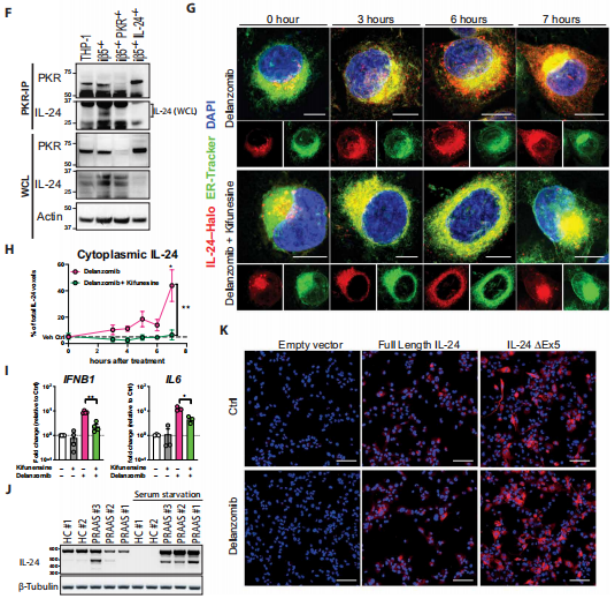
图3 IL-24在蛋白酶体抑制的条件下激活PKR
(图片来源于《Science Immunology》杂志)
研究者观察到蛋白酶体亚单位突变患者的成纤维细胞和外周血单个核细胞(PBMC)的IL-24、磷酸化的PKR和eIF2水平增加。用 PKR 抑制剂 C16 治疗 PRAAS PBMC可消除 PBMC患者中的 PKR 磷酸化,从而导致患者细胞中 STAT1 和 eIF2α的活化减少,显著降低了PRAAS患者外周血单核细胞中IFN-αβ和ISG基因的表达。在婴儿期发作的 STING 相关血管病 (SAVI)患者的 PBMC 样本中,PKR 抑制不会改变 IFN-αβ亚型或 ISG 基因表达,说明这个途径在PRAAS中是特有的。在PRAAS患者来源的细胞中IFN-αβ亚型转录升高,使用C16可使其正常化。(见图4)
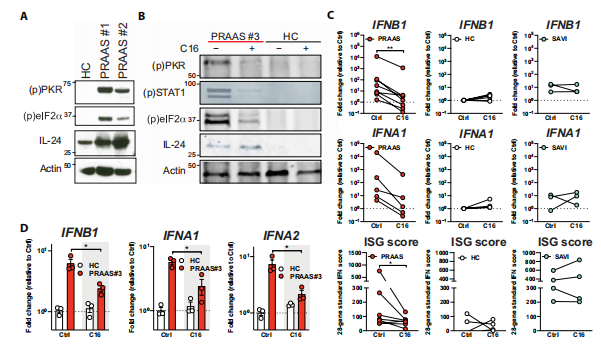
图4 PKR在PRAAS患者样本中介导炎症信号传导
(图片来源于《Science Immunology》杂志)
总的来说,这些发现不仅对 PRAAS 具有重要意义,而且对与蛋白毒性应激和炎症相关的其他疾病(例如神经退行性疾病)也具有重要意义。为开发PKR抑制药物,靶向治疗蛋白酶体功能障碍提供了参考。
云克隆开发了上述研究中涉及的相关指标的蛋白、抗体、ELISA试剂盒等产品以助力肿瘤治疗相关研究,部分指标节选如下,供参考。