文献解读 | 分化细胞的时空重编程是肠上皮再生和肿瘤形成的基础

2022 年 3 月 21 日,九 州 大 学 生 物 调 节 医 学 研 究 所 分 子 与 细 胞 生 物 学 系 Keiichi I. Nakayama 及 团 队 在《NATURE COMMUNICATIONS》上 发 表 题 为“Spatiotemporal reprogramming of difffferentiated cells underlies regeneration and neoplasia in the intestinal epithelium”的文章,强调了肠道上皮具有明显的可塑性,在正常和肿瘤情况下支持组织完整性的维护。

在这篇文章中,云克隆抗体【胃内因子(GIF)多克隆抗体,PAD111Mu01】受到科研工作者的认可,荣登优秀国际期刊。

研究介绍:
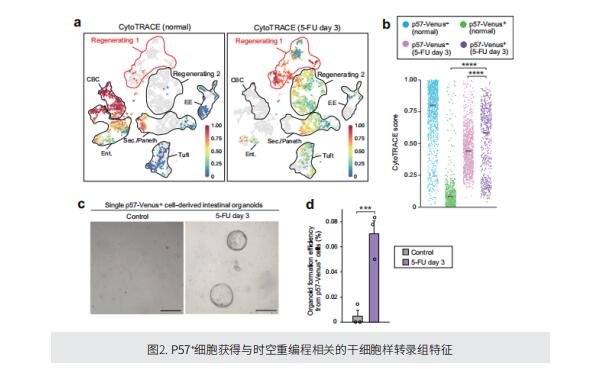
哺乳动物肠道上皮细胞的快速更替和再生得益于定位于肠隐窝的功能独特的肠干细胞 (ISCs) 群体。高水平表达Lgr5 的隐窝基柱状细胞 (CBCs) 通过在竞争生态位空间的同时发挥等势干细胞池的功能,驱动稳态上皮细胞更替。然而,Lgr5highCBCs 的完全丧失并不能阻止肠上皮的维持,这表明存在替代的 ISCs 种群。 基于静止是未分化组织干细胞的特征这一概念,作者提出了一种罕见的、有丝分裂不活跃的细胞,位于相对于肠隐窝基底的 +4 位置附近,可作为一个专用的、原始的静止的 ISCs 群体。p57(CDKN1C) 蛋白是一种细胞周期蛋白依赖性激酶抑制剂,在造血干细胞和神经干细胞中特异性表达。作者研究显示 p57 在位于肠隐窝 +4 位置周围的静止细胞中特异性表达。谱系追踪显示,这些 p57+ 细胞是正常隐窝中的场内分泌和簇状(EE/tuft)细胞前体,但它们响应损伤恢复到干细胞状态,作为兼性 ISCs 发挥作用。单细胞转录组学分析表明,p57+EE/tuft 谱系细胞获得了类似于Clu+revSCs 和胎儿肠道的转录组特征,因此它们可作为损伤后再生过程中出现的中间 ISCs 的来源。伴随这种胎儿样逆转,作者发现 p57+ 细胞在损伤后重编程过程中经历了化生样转化,其特征在于获得类似于成人胃上皮细胞的转录组学特征。进一步的群体和组织学水平分析表明,这种“时空重编程”也广泛发生在 p57+ 细胞以外的细胞中。此外,在肠腺瘤中,p57+ 细胞在组成性激活时空重编程的背景下表现出稳态干细胞活性。 总之,作者目前的结果揭示了维持正常和新生肠上皮组织完整性的系统的可塑性。阐明和操纵这种可塑性背后的分子机制可能在再生医学领域以及癌症治疗中具有临床重要性。未来对 p57+ 细胞的研究应进一步深入了解组织维持系统的多样性,并有助于识别各种组织和疾病背景下未探索的干细胞群。