文献解读 | 一种用于癌症治疗的细胞焦亡纳米调节器

2022年5月23日,北京大学药学院天然与仿生药物国家重点实验室Yiguang Wang和北京大学医学部肿瘤系统生物学北京市重点实验室Fuping You团队在《Nature Nanotechnology》上发表题为“A pyroptosis nanotuner for cancer therapy”的文章,为如何通过针对生物医学应用的不同内吞信号的特异性靶向来设计具有可调细胞焦亡活性的纳米药物提供了新的见解。

在这篇文章中,云克隆试剂盒【三磷酸肌醇(IP3)检测试剂盒(酶联免疫吸附试验法),CEC037Ge】受到科研工作者的认可,荣登优秀国际期刊。


细胞焦亡是一种程序性细胞死亡模式,其特点是细胞膜迅速破裂,细胞肿胀伴有大气泡,并释放细胞促炎内容物。最近,gasdermin E (GSDME) 被确定为 caspase-3 的底物,可导致癌细胞焦亡并诱导化疗药物的全身副作用。此外,gasdermins 的裂解会触发炎性肿瘤微环境并增强癌症免疫治疗的功效。越来越多的证据表明,细胞焦亡可以由内吞细胞器应激诱导。各种无机纳米粒子以不受控制的方式在不同细胞类型中诱导细胞焦亡。这些纳米粒子引起的细胞焦亡具有潜在的生物医学应用价值。在癌症治疗中,迫切需要开发一种强大的纳米技术来实现针对癌症而不是正常组织的细胞焦亡杀伤作用。
在这项研究中,作者设计了一个小型酸激活纳米光敏剂 (ANPS) 库,具有从 6.9 到 5.3 的明显 pH 转变,涵盖了内体成熟阶段的整个 pH 范围。利用ANPS平台,他们成功地将整个内吞体成熟途径划分为十个内吞区域(pH区间,0.2),并通过精确靶向每个酸性内吞区域,在体外和体内系统地研究了它们精细调控癌细胞内吞诱导活性的能力。他们发现ANPS可以特异激活磷脂酶C (PLC),通过脂质过氧化信号转导,特异性诱导GSDME介导的各种GSDME阳性癌细胞的焦亡,这是一个由纳米光敏剂介导的早期核内体氧化应激启动的过程;然而,在纳米碳转运到晚期核内体和溶酶体后,其焦亡诱导活性显著降低。因此,这种细胞焦亡纳米调节器在体内对各种表达GSDME的人类癌症类型取得了显著的治疗效果,并且全身副作用最小。
综上所述,作者成功地制作了一个 ANPS 文库,它在时空上将内溶酶体途径区分为 10 个不同的成熟阶段,可将光动力氧化应激引入特定的酸性内吞区域,并进一步实现细胞焦亡的位置依赖性和细胞器特异性可调性。纳米调谐器策略实现了对各种 GSDME 阳性癌细胞类型的强大细胞焦亡杀伤,同时降低了全身毒性。该研究为基于早期内体靶向信号传导的新型疗法合理设计具有焦亡调节活性的纳米药物铺平了道路,同时也为探索用于癌症免疫治疗的纳米材料介导的焦亡提供了新的机会。
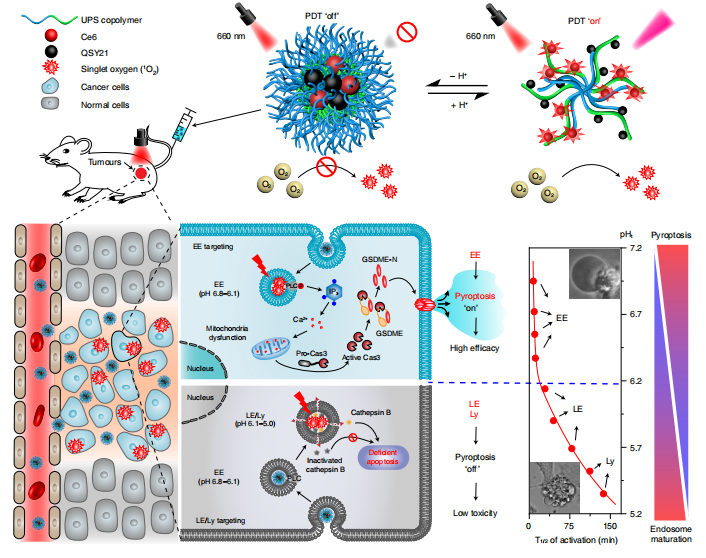
图1. ANPS的示意图和ANPS文库通过核内体成熟的时间分化引起的可调焦亡
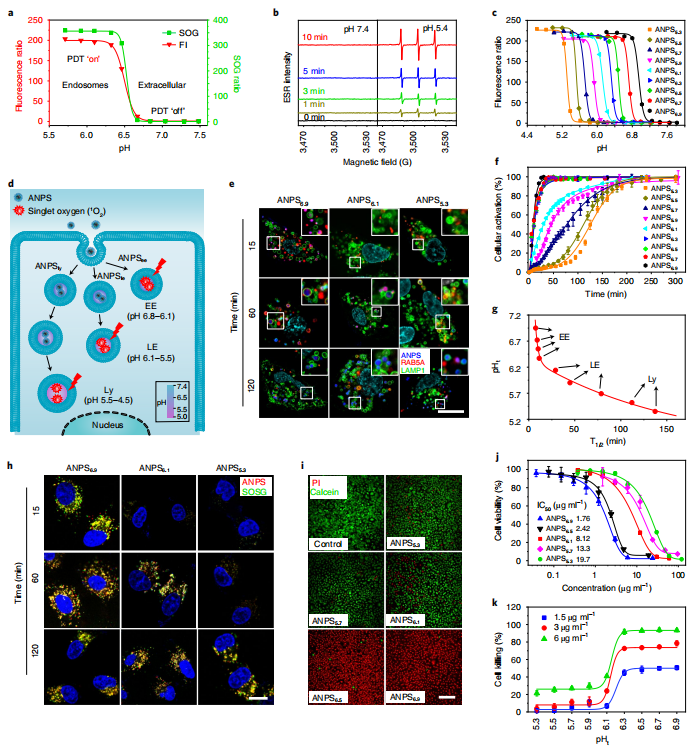
图2. 通过设计具有pH 分化能力的 ANPS 文库来调整细胞器特异性细胞毒性
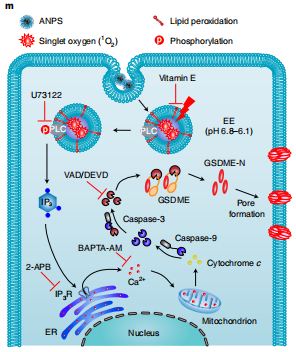
图3.靶向早期内体光动力疗法诱发的GSDME介导的焦亡机制