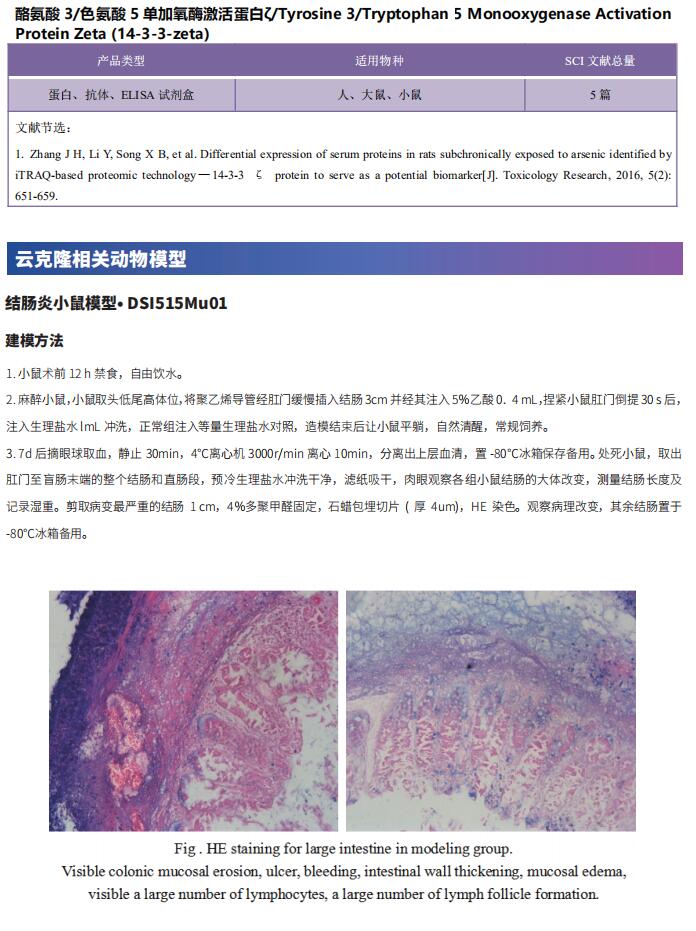
结直肠癌进展和转移机制研究新发现
结直肠癌 (CRC) 是最常见的人类恶性肿瘤之一,在世界范围内有着较高的发病率和死亡率。虽然早期 CRC 可以通过手术治愈,但转移性CRC的全身治疗仍然依赖于传统的基于 5-氟尿嘧啶 (5-FU) 的化疗方案。此外,CRC患者经常发生耐药性,是导致不良预后的主要原因。而新型靶向治疗和免疫治疗仅在有限的 CRC 患者亚群中显示有效。因此,迫切需要了解 CRC 发展和治疗耐药性的分子机制,以便实施量身定制的、更有效的治疗。
1. AP4在CRC中通过诱导 MDC1和抑制miR-22-3p 来抑制 DNA 损伤并有助于耐药
AP4编码bHLH-LZ转录因子,是致癌转录因子c-MYC的直接靶基因。德国路德维希-马克西米利安大学病理研究所Heiko Hermeking团队试图确定AP4在人类CRC细胞中的作用[1]。他们采用 CRISPR/Cas9 方法生成具有 c-MYC 可诱导表达的 AP4 缺陷型 CRC 细胞系。CRC 细胞系中 AP4 的失活导致自发和 c-MYC 诱导的 DNA 损伤、染色体不稳定性 (CIN) 和细胞衰老增加(图1)。AP4 缺陷细胞显示出长链非编码 RNA MIR22HG 的表达增加,该 RNA MIR22HG 编码 miR-22-3p 并被 AP4 直接抑制。此外,DNA 损伤检查点 1 (MDC1)在 AP4 缺陷细胞中表现出降低的表达。抑制miR-22-3p或异位MDC1表达可逆转AP4缺陷的CRC细胞衰老增加、DNA损伤、CIN。AP4缺陷也使CRC细胞对5-FU治疗敏感,而异位AP4通过miR-22-3p和MDC1依赖的方式赋予5-FU耐药性。这些发现解释了在 c-MYC 激活后,AP4 表达升高如何促进CRC的起始、维持、进展和化疗耐药性,可能为CRC治疗提供帮助。

图1 AP4失活诱导CRC细胞DNA损伤和衰老
2. lncRNA MIR100HG与hnRNPA2B1的相互作用促进m6A依赖的TCF7L2 mRNA的稳定和CRC进展
上皮间质转化 (EMT) 是与转移和耐药性相关的过程,其中非编码 RNA (ncRNA) 发挥着关键作用。第四军医大学西京消化疾病医院肿瘤生物学国家重点实验室Yuanyuan Lu团队研究了MIR100HG在CRC西妥昔单抗耐药或 EMT 中的作用[2]。MIR100HG的表达与EMT标志物密切相关,是EMT的正向调节因子。MIR100HG 在体外和体内均能维持西妥昔单抗耐药并促进 CRC 细胞的侵袭和转移。hnRNPA2B1 被鉴定为 MIR100HG 的结合因子。从机制上讲,MIR100HG 通过与 hnRNPA2B1 相互作用维持 TCF7L2(Wnt/β-catenin 信号传导的主要转录共激活因子) 的 mRNA 稳定性(图2)。hnRNPA2B1 在 MIR100HG 存在下识别 TCF7L2 mRNA 的 N6-甲基腺苷 (m6A) 位点。此外,MIR100HG/hnRNPA2B1/TCF7L2轴在发生局部或远处转移或与西妥昔单抗耐药相关的疾病进展的CRC患者标本中增强。这些结果提示 MIR100HG 可能是CRC 中的有效 EMT 诱导剂,通过激活 MIR100HG/hnRNPA2B1/TCF7L2 反馈回路导致西妥昔单抗耐药和转移。

图2 lncRNA MIR100HG与hnRNPA2B1的相互作用促进m6A依赖的TCF7L2 mRNA的稳定和CRC进展
3. PIK3CA 突变介导的 circLHFPL2 下调通过上调 PTEN 抑制CRC进展
PIK3CA 突变和 PTEN 抑制导致CRC的肿瘤发生和耐药性。同济大学医学院上海东方医院肿瘤科Yong Gao团队探讨circLHFPL2 在CRC中调控PIK3CA突变和MEK抑制剂耐药中的作用[3]。RNA 测序确定 circLHFPL2 在 PIK3CAH1047R (HCT116) 和 PIK3CAE545K (DLD1) 细胞中的表达下调。CircLHFPL2 在 PIK3CA 突变的 CRC 原代细胞和组织中也下调,并与不良预后相关。 CircLHFPL2 主要定位于细胞质,其下调归因于磷酸化 Foxo3a 激活的 PI3K/AKT 信号通路。 CircLHFPL2 在体外和体内均抑制 PI3KCA-Mut CRC 进展。机制分析显示,circLHFPL2 作为 ceRNA 在 CRC 细胞中海绵吸附 miR-556-5p 和 miR-1322,进而调节 PTEN 的表达(图3)。此外,circLHFPL2 的下调导致 CRC 中的 MEK 抑制剂耐药性。因此,靶向circLHFPL2可能是治疗携带致癌PIK3CA突变的CRC患者的有效方法。
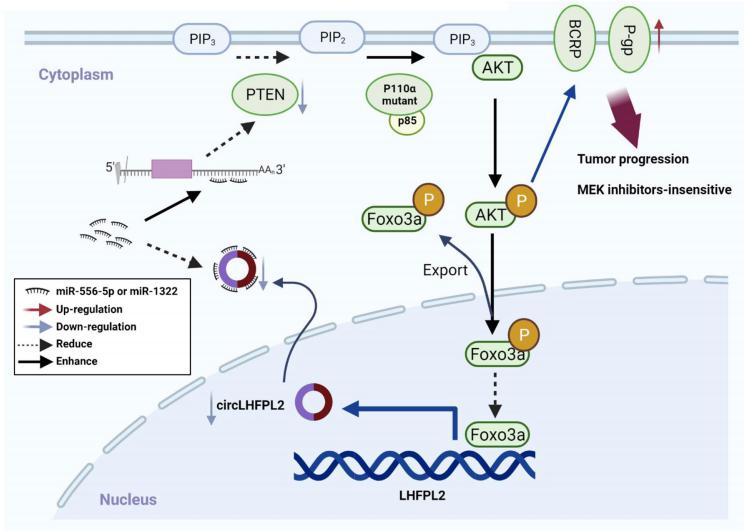
图3 在PIK3CA突变的CRC细胞中,通过circLHFPL2/miR-556-5p和miR-1322/PTEN轴持续激活PI3K/AKT增强MEK抑制剂耐药性
4. circALG1 的 m6A修饰促进 miR-342-5p/PGF 信号通路介导的结直肠癌转移
中南大学湘雅第三医院胃肠外科Gui Hu团队使用人类 circRNA 芯片检测CRC患者的癌症和癌旁组织以及 CRC 患者和健康个体外周血标本中 circRNA 的表达谱[4]。他们发现circALG1在结直肠癌患者外周血和肿瘤组织中均高表达,与结直肠癌转移密切相关。circALG1过表达促进了CRC细胞的迁移和侵袭,circALG1沉默和circALG1 m6A修饰水平的降低抑制了CRC细胞的迁移和侵袭。体内实验进一步证实了 circALG1 在 CRC 中的促转移作用。进一步的机制研究表明,circALG1 通过与 miR-342-5p 结合上调胎盘生长因子 (PGF) 的表达,m6A 修饰增强了 circALG1 与 miR-342-5p 的结合并促进其 ceRNA 功能(图4)。这些结果表明circALG1可能成为CRC的潜在治疗靶点和预后标志物。

图4 CircALG1通过竞争性结合miR-342-5p缓解miR-342-5p对PGF mRNA表达的抑制作用,促进PGF表达,导致CRC侵袭增强
参考文献
[1]Chou J, Kaller M, Jaeckel S, Rokavec M, Hermeking H. AP4 suppresses DNA damage, chromosomal instability and senescence via inducing MDC1/Mediator of DNA damage Checkpoint 1 and repressing MIR22HG/miR-22-3p[J]. Mol Cancer. 2022,21(1):120. (IF=27.401)
[2]Liu H, Li D, Sun L, et al. Interaction of lncRNA MIR100HG with hnRNPA2B1 facilitates m6A-dependent stabilization of TCF7L2 mRNA and colorectal cancer progression[J]. Mol Cancer. 2022,21(1):74. (IF=27.401)
[3]Chong X, Chen J, Zheng N, et al. PIK3CA mutations-mediated downregulation of circLHFPL2 inhibits colorectal cancer progression via upregulating PTEN[J]. Mol Cancer. 2022,21(1):118. (IF=27.401)
[4]Lin C, Ma M, Zhang Y, et al. The N6-methyladenosine modification of circALG1 promotes the metastasis of colorectal cancer mediated by the miR-342-5p/PGF signalling pathway [J]. Mol Cancer. 2022,21(1):80. (IF=27.401)
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标及上述Wnt/β-catenin、PI3K/AKT通路相关产品,可助力广大科研工作者进行癌症相关研究。