文献解读 | 综合表观基因组和转录组分析揭示JUNB对造血命运诱导的重要作用

2022年6月6日,清华大学医学院干细胞生物学与再生医学研究中心Jie Na团队在《Nature Communications》上发表题为“Integrative epigenomic and transcriptomic analysis reveals the requirement of JUNB for hematopoietic fate induction”的文章,发现 JUNB 是造血内皮细胞特化和内皮细胞向造血细胞转变的重要调节剂。

在这篇文章中,云克隆抗体【豚鼠抗兔IgG多克隆抗体(无标记),SAA544Rb50】受到科研工作者的认可,荣登优秀国际期刊。


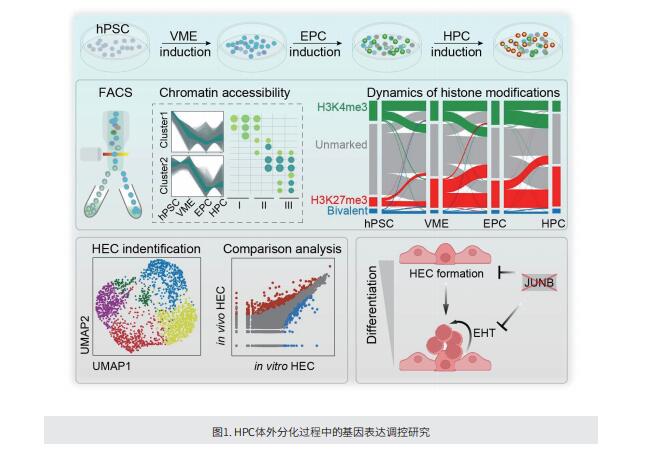
人类多能干细胞(hPSC)分化为造血祖细胞(HPC)可以再现人类胚胎的造血功能,并为研究HPC命运的机制提供平台。遗传和功能研究揭示了调节 HPC 形成的各种信号通路和转录因子。然而,HPC 形成背后的全局转录控制机制仍然非常模糊。染色质重塑和组蛋白修饰对转录调控至关重要。在PSC中,许多控制细胞谱系规范的发育基因通常由 H3K4me3 和 H3K27me3 标记,这些基因被称为“二价”基因,它们在细胞系确定时被迅速激活。剖析 HPC 分化过程中二价基因的动态可能揭示导致体内和体外 HPC 形成的潜在调节剂。
在这项研究中,作者全面分析了HPC分化过程中不同阶段的全局基因表达、染色质可及性、H3K4me3和H3K27me3修饰,还使用单细胞RNA-seq (scRNA-seq)和单细胞ATAC-seq (scATAC-seq)来揭示内皮细胞(EC)向造血细胞的转变窗口期间EC和HPC中亚群的转录组和开放染色质特征。综合分析揭示了造血转录因子结合区域的顺序开放和二价基因的逐步表观遗传重编程,描述了HPC分化过程中染色质配置和基因表达的时间变化,并鉴定了协调HPC生成的调控因子。他们发现,JUNB是造血内皮专化和内皮向造血转化的重要调节因子,JUNB 缺乏会显著抑制体外系统中 HEC 和 HPC 的生成。
综上所述,作者全面的表观遗传学和转录分析以及综合分析表明,染色质变化在体外HPC分化中起重要作用,导致类似于人类胚胎体内造血的HPC形成。本研究丰富了人类系统造血功能表观遗传调控的知识,可能为优化体外分化和获得具有更强大造血潜能的HEC和HPC提供线索。