糖尿病研究新发现
糖尿病是世界范围内一个严重的健康问题。它是由于胰腺中的β细胞不能产生足够的胰岛素或体内细胞不能有效利用胰岛素而导致血液中长期的高葡萄糖水平引起的。一般来说,糖尿病可分为1型糖尿病(T1D)和2型糖尿病(T2D)。作为一种慢性疾病,糖尿病往往会增加由大血管和微血管损伤引起的其他几种疾病的风险,并对大脑、肾脏、心脏和眼睛等多个器官产生负面影响。此外,糖尿病患者更容易感染。近期,多篇文献报道了糖尿病相关研究,可能为糖尿病的预防和治疗提供帮助。
1.FABP4和核苷激酶的激素复合物调节胰岛功能
从脂肪细胞中释放能量储存对于在能量不足时支持生存至关重要,然而,与胰岛素抵抗和/或胰岛素不足相关的不受控制或慢性脂肪分解会破坏代谢稳态。哈佛大学陈曾熙公共卫生学院GökhanS.Hotamisligil团队的研究显示激素脂肪酸结合蛋白4(FABP4)与腺苷激酶(ADK)和核苷二磷酸激酶(NDPK)形成一种新型功能性激素复合物,以调节细胞外ATP和ADP水平[1]。他们确定了这种激素对β细胞的重大影响,并鉴于β细胞功能在控制脂肪分解和糖尿病发展中的核心作用,假设激素FABP4是脂肪β细胞内分泌轴的关键调节因子。这种激素复合物的抗体介导靶向改善代谢结果,增强β细胞功能,并保持β细胞完整性(图1),以预防1型和2型糖尿病。因此,FABP4-ADK-NDPK复合物(Fabtin)代表了一种此前未知的激素和作用机制,它将能量状态与代谢器官的功能结合起来,是治疗代谢性疾病的一个有希望的靶点。
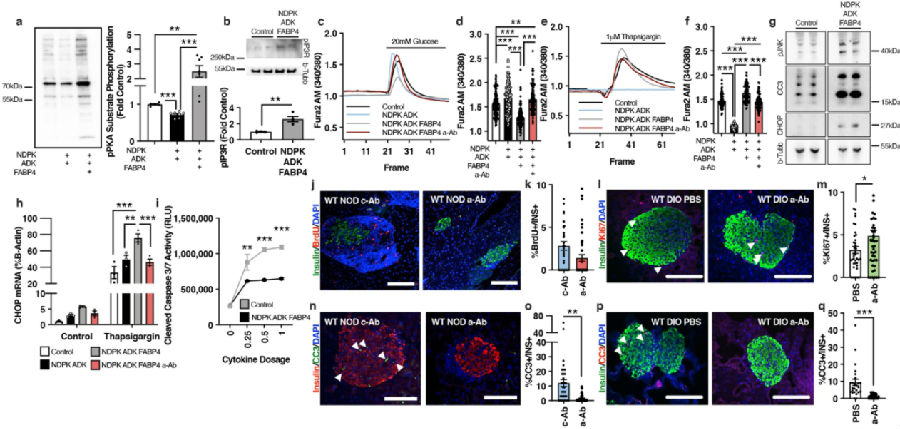
图1.FABP4-ADK-NDPK复合物改变β细胞钙动态并促进细胞死亡
2.运动诱导代谢物抑制进食和肥胖
运动可以预防肥胖、 2型糖尿病和其他心脏代谢疾病。然而,介导身体活动代谢益处的分子和细胞机制仍不清楚。美国加州斯坦福大学医学院病理学系JonathanZ.Long团队证明了运动可以刺激N-乳酰苯丙氨酸(Lac-Phe)的产生,这是一种血液传播的信号代谢物,可以抑制进食和肥胖[2]。乳酸和苯丙氨酸对Lac-Phe的生物合成发生在CNDP2+细胞中,包括巨噬细胞、单核细胞和其他定位于不同器官的免疫细胞和上皮细胞。在饮食诱导的肥胖小鼠中,药理学介导的Lac-Phe增加会减少食物摄入,而不会影响运动或能量消耗。长期服用Lac-Phe可降低肥胖和体重并改善葡萄糖稳态(图2)。相反,小鼠体内Lac-Phe生物合成的基因消融会增加运动训练后的食物摄入和肥胖。这些数据表明运动诱导代谢物Lac-Phe可以控制食物摄入并影响系统能量平衡,可作为糖尿病等代谢疾病的潜在治疗靶点。
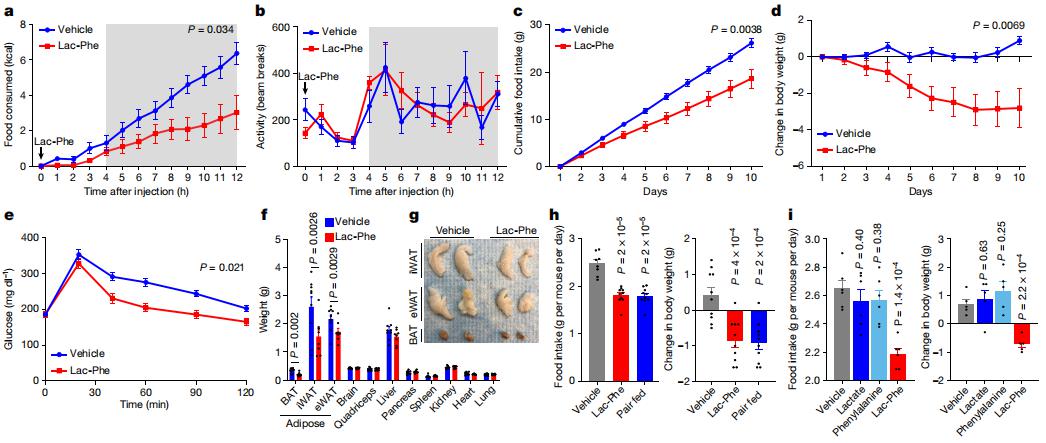
图2.Lac-Phe抑制食物摄入和肥胖,改善葡萄糖稳态
3.饱和脂肪酸对β细胞FIT2的不稳定会改变脂滴数量并导致内质网应激和糖尿病
西式饮食与肥胖和糖尿病有关,部分原因在于其高饱和脂肪酸(SFA)含量。新加坡南洋理工大学李光前医学院YusufAli团队发现SFA可减少胰腺β细胞内的脂滴(LD)[3]。从机制上讲,SFA通过诱导S-酰基化和蛋白酶体介导的脂肪储存诱导跨膜蛋白2(FIT2)降解来减少LD的形成。FIT2的靶向消融降低了β细胞LD数量和ATP水平,减少了Ca2+信号传导,抑制了囊泡胞吐作用,加剧了饮食诱导的小鼠糖尿病(图3)。质谱研究显示,缺乏β细胞FIT2的饮食诱导糖尿病小鼠胰岛中C16:0神经酰胺积累增加。神经酰胺合成酶的抑制可改善内质网应激和胰岛素分泌。FIT2在糖尿病小鼠胰岛中减少,FIT2的过表达增加了细胞内LD的数量,挽救了SFA诱导的内质网应激和细胞凋亡。这些结果表明,恢复LD的形成,特别是在脂肪毒性环境中,如肥胖和糖尿病,对于预防β细胞功能障碍和损失具有相当大的治疗价值。
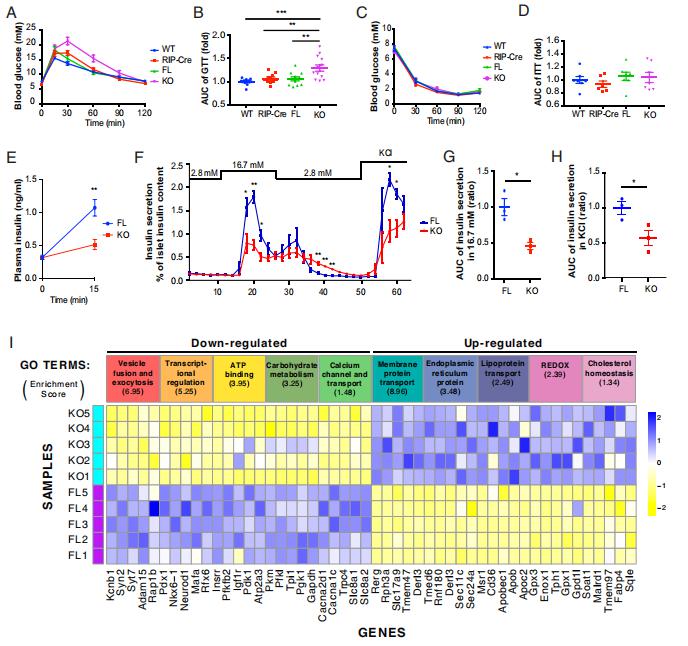
图3.βFIT2KO小鼠葡萄糖稳态和β细胞功能受损
4.靶向SLC7A11改善糖尿病患者的胞葬作用和创面愈合
慢性无法愈合的伤口是糖尿病的一个主要并发症。比利时VIB炎症研究中心KodiS.Ravichandran团队揭示了膜转运蛋白SLC7A11在胞葬作用(即死亡细胞被清除的过程)中发挥分子制动作用,并且抑制SLC7A11功能可以加速伤口愈合[4]。小鼠树突状细胞的转录组学鉴定了几个SLC7基因家族成员的上调。在进一步的分析中,SLC7A11的药理学抑制,或使用小干扰RNA删除或敲低SLC7A11可增强树突状细胞中的胞葬作用。机制研究揭示了SLC7A11、葡萄糖稳态和糖尿病之间的联系。SLC7A11缺陷型树突状细胞依赖有氧糖酵解,使用源自糖原储存的葡萄糖来增加胞葬作用;SLC7A11缺陷的树突状细胞的转录组学发现与糖异生和糖尿病相关的基因表达增加。此外,SLC7A11在易患糖尿病的小鼠的伤口中表达更高,靶向SLC7A11加速了它们的伤口愈合。更快的愈合还与TGFβ家族成员GDF15从树突状细胞的释放有关(图4)。总之,SLC7A11是胞葬作用的负调节因子,去除这种制动可以改善伤口愈合,对糖尿病的伤口管理有重要意义。
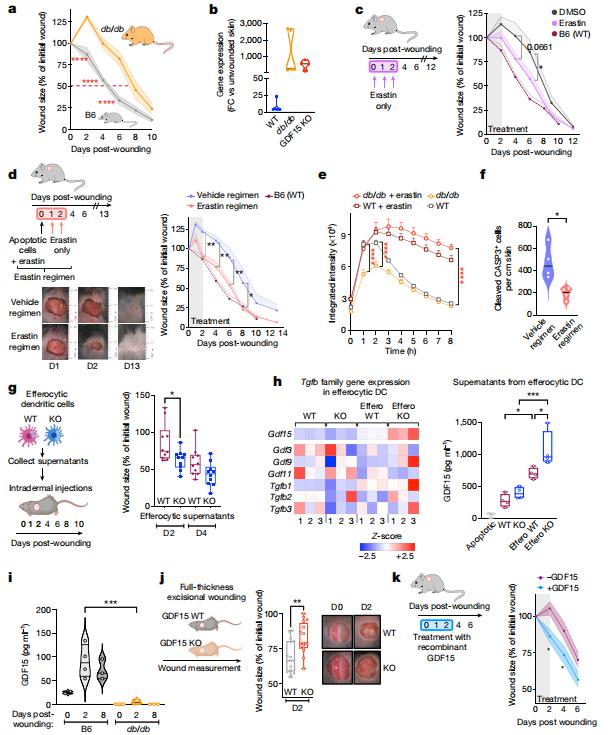
图4.SLC7A11抑制和GDF15促进糖尿病小鼠皮肤创面愈合
参考文献
[1]Prentice KJ, Saksi J, Robertson LT, et al. A hormone complex of FABP4 and nucleoside kinases regulates islet function[J]. Nature. 2021,600(7890):720-726. (IF=49.962)
[2]Li VL, He Y, Contrepois K, et al. An exercise-inducible metabolite that suppresses feeding and obesity[J]. Nature. 2022,606(7915):785-790. (IF=49.962)
[3]Zheng X, Ho QWC, Chua M, et al. Destabilization of β Cell FIT2 by saturated fatty acids alter lipid droplet numbers and contribute to ER stress and diabetes[J]. Proc Natl Acad Sci U S A. 2022,119(11):e2113074119.(IF=11.205)
[4]Maschalidi S, Mehrotra P, Keçeli BN, et al. Targeting SLC7A11 improves efferocytosis by dendritic cells and wound healing in diabetes[J]. Nature. 2022,606(7915):776-784.(IF=49.962)
云克隆不仅可提供多种代谢疾病动物模型,涵盖糖尿病、高尿酸、非酒精性脂肪肝、高血脂、动脉粥样硬化等常见疾病。还具有各类代谢疾病检测指标及上述FABP4、ADK、SLC7A11等相关产品,可助力广大科研工作者进行代谢疾病相关研究。