肿瘤治疗之BRAF
braf是一种位于7号染色体的原癌基因,有18个外显子,编码丝氨酸/苏氨酸蛋白激酶,在恶性肿瘤形成、发展过程中发挥重要作用。
BRAF蛋白与KRAS蛋白同为RAS-RAF-MEK活化的细胞外信号调节激酶,在MAPK/ERK信号通路中起着关键作用。braf基因最常见的活化突变在1799位核苷酸的第15外显子中发现,该突变将胸腺嘧啶转换为腺嘌呤,导致其编码的缬氨酸变为谷氨酸,即BRAF V600E突变(占BRAF所有突变的80 %)。这一突变使BRAF蛋白持续激活,活性提高约500倍,并且能够不依赖于上游RAS激酶单体,持续激活下游的ERK,最终导致细胞的无限增殖和分裂。
braf基因突变在许多不同的癌症中都有发现,约100%的毛细胞白血病、50%的黑色素瘤、20%~40%甲状腺癌、10%~15%的结直肠腺癌、10%的脑胶质瘤、4%的非小细胞肺癌,小概率发生在其它类型白血病和卵巢癌中。因此BRAF是许多癌症检查及药物研发的重要靶点。近期,已有多篇文献报道有关BRAF靶点作用的机制和转化研究。
巨噬细胞集落刺激因子(M-CSF)作为BRAFV600E黑色素瘤对BRAF抑制剂耐药的治疗靶点
BRAF抑制剂(BRAFi)例如Vemurafenib对弥散性BRAFV600E黑色素瘤有一定治疗效果,可减少细胞增殖和黑色素瘤进展,但易产生耐药性,预后不良。西班牙莱里达大学肿瘤病理团队通过分析黑色素瘤细胞的条件培养液,Vemurafenib治疗可降低普通培养Vemurafenib敏感(Vem-S)黑色素瘤细胞的活力。然而,当细胞在用Vemurafenib耐药黑色素瘤细胞系的分泌培养基(Vem-R CM)中培养时,Vemurafenib治疗不会改变Vem-S细胞的活力和迁移/侵袭率。对异种移植重症联合免疫缺陷(SCID)小鼠中的配对黑色素瘤细胞和肿瘤生长进行活性和迁移/侵袭试验,结果发现,BRAFi耐药黑色素瘤细胞分泌体富含促肿瘤细胞因子,M-CSF分泌对于在黑色素瘤细胞中诱导Vemurafenib耐药表型至关重要(图1)。此外,实验中还证明M-CSF单抗与Vemurafenib和自噬阻断剂联合使用可协同诱导BRAFi耐药黑色素瘤细胞的凋亡、损害迁移和减少肿瘤生长。该团队分析了35例转移性BRAFV600E突变黑色素瘤患者的M-CSF血浆水平与临床预后的关联,发现在转移性黑色素瘤患者中,较低的M-CSF血浆水平与更好的预后相关。这些结果表明,分泌型M-CSF是治疗BRAFi耐药黑色素瘤的一个有希望的靶点。
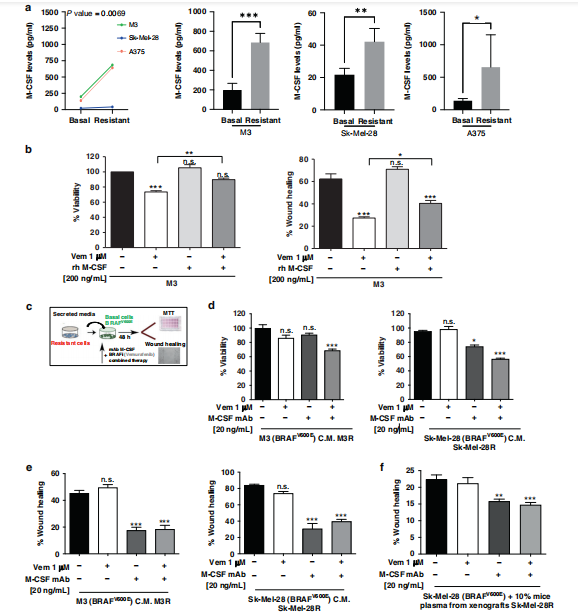
图1 M-CSF 促进 BRAFV600E黑色素瘤细胞获得 Vemurafenib 抗性。
AK2是BRAF在肿瘤发生中的AMP感应负调节因子
腺苷酸激酶2(AK2)控制腺嘌呤核苷酸库的合成和消耗的平衡。除此之外,最近的研究表明AK2是一种多功能蛋白,人类AK2缺乏会造成网状发育不全,这是一种最严重的先天性人类重症联合免疫缺陷(SCID) 。AK2 可以在胞质溶胶中形成一种新的含有Fas相关死亡域蛋白(FADD)和半胱天冬酶-10凋亡复合物,在细胞凋亡中有着重要作用。韩国首尔国立大学的研究团队通过在体外试验和细胞模型中发现,AK2与BRAF相互作用并抑制BRAF活性和下游ERK磷酸化。细胞模型中的能量剥夺条件和向细胞裂解物中添加AMP增强了AK2-BRAF相互作用,表明AK2参与调节BRAF活性以响应细胞代谢状态。AMP通过与AK2 结合促进AK2-BRAF复合物的形成。在肝细胞癌(HCC)小鼠模型中,RAS的激活消除了AK2/BRAF相互作用,并且AK2的消融促进了肿瘤生长和BRAF活性。AK2 还与对BRAF抑制剂不敏感的BRAF突变体结合并减弱它们的活性。从这些发现中研究团队最终提出了一个RAS、AK2、BRAF、AMP相互作用的模型(图2)。在AMP水平较高的静息状态下,AK2感知AMP 并与BRAF形成蛋白质复合物,从而抑制BRAF的活性。在有丝分裂原刺激和RAS激活后,AK2从BRAF释放,导致BRAF激活。
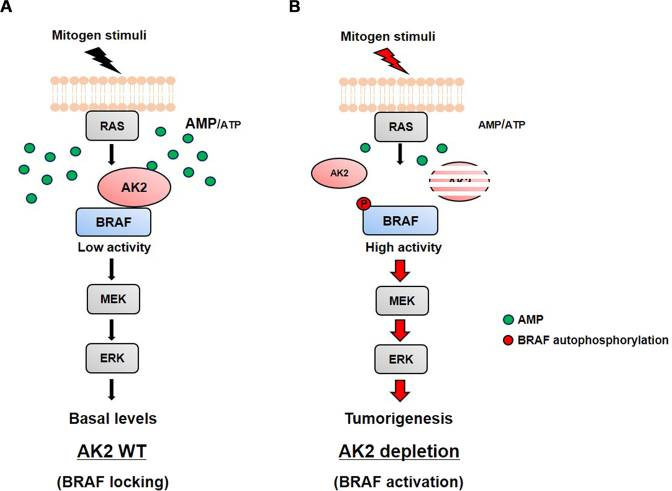
图2 RAS、AK2、BRAF、AMP相互作用模型:AK2在RAS-BRAF信号传导中充当BRAF锁定器。
雄激素受体阻断促进对BRAF/MEK靶向治疗的效果
靶向BRAF/MEK的治疗对黑色素瘤和其他肿瘤有较好的效果,但是治疗产生的耐药性依然很普遍。目前有多项研究表明男性与黑色素瘤患者的预后不良相关,在经典的激素反应性肿瘤例如前列腺癌中,雄激素受体(AR)信号与MAPK以及其他信号途径之间的相互作用已有相关研究成果。但是这些在黑色素瘤和其他癌症中研究较少。来自德克萨斯大学MD安德森癌症中心的Jennifer A. Wargo团队对这方面进行了研究。团队研究了一组接受8-12周新辅助BRAF/MEK靶向治疗的局部转移性黑色素瘤患者。结果发现,女性患者的病理缓解率和无复发生存期高于男性患者,而且雌激素在这一治疗中没有主要作用。男性患者在治疗期间的AR水平显著升高,而对靶向联合治疗没有反应的男性和女性患者在治疗期间的AR水平也显著升高。研究者运用小鼠模型来验证这些发现,用CRISPR技术制作了雄激素受体敲除(AR-KO)黑色素瘤细胞系,植入雌雄小鼠体内,并用BRAF/MEK靶向治疗。与对照组相比,雌雄小鼠的肿瘤控制都有效且相当。这表明雄激素受体的表达有助于对BRAF/MEK靶向治疗抵抗。值得注意的是与雌性小鼠相比,雄性小鼠的雄激素受体的基线和治疗时的表达水平明显升高,这可能与雄性小鼠中较高水平的睾酮有关。但是血浆睾酮没有明显变化。这表明肿瘤细胞中的雄激素受体驱动了BRAF/MEK靶向治疗的反应差异,并且雄激素受体高表达可以促进黑色素瘤细胞的增殖。对小鼠进行去势可以显著提高它们对BRAF/MEK靶向治疗的反应,这种效果在进行睾酮给药后会消失。这个研究结果表明BRAF/MEK靶向治疗抵抗与雄激素受体表达增加有关,有益于解决肿瘤治疗中的耐药性。
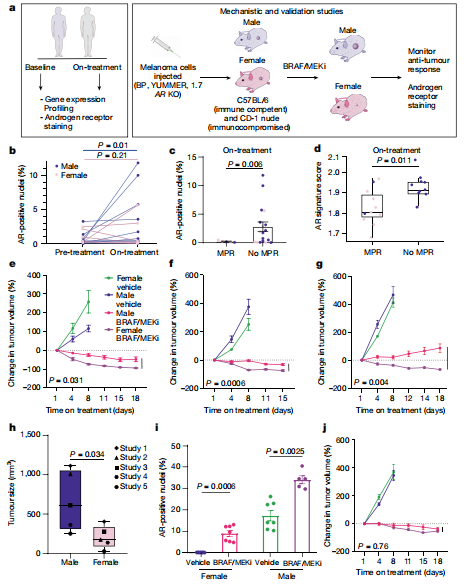
图3 BRAF/MEK靶向治疗抵抗与AR表达增加有关
靶向髓源性抑制细胞(MDSCs)可使BRAF突变型甲状腺乳头状癌对MAPK抑制剂敏感
BRAFV600E是与甲状腺乳头状癌(PTC)相关的最常见基因突变,可异常激活MAPK通路,抑制谱系分化分子表达,与肿瘤复发、进展和治疗抵抗高度相关。天津医科大学基础医学院赵丽教授团队揭示了进展型甲状腺乳头状癌免疫逃逸分子机制及靶向治疗的研究进展。团队采用早发型和诱发型小鼠原位甲状腺癌模型,结合FACS 芯片,发现骨髓源性抑制细胞(MDSCs),特别是粒细胞样MDSCs(G-MDSCs)与BRAFV600E诱发的PTC进展密切相关,导致CD8+T细胞/G-MDSCs比率显著下降,形成免疫抑制微环境,实现肿瘤免疫逃逸和生长。
团队的前期研究发现TBX3与PTC的侵袭度及淋巴结转移正相关,并显著促进肿瘤细胞增殖。在本次研究中发现,TBX3显著影响众多炎症因子和趋化因子丰度,特别是CXCR2配体分子(CXCL1,2和8)在TBX3缺陷肿瘤和细胞中显著下调。通过大量实验验证发现TBX3通过转录调控TLR2-NF-κB炎症信号轴实现了对趋化因子水平的调控,而后者以自分泌的方式促进癌细胞自身的增殖,以旁分泌的方式促进MDSCs,特别是G-MDSCs的过度趋化招募及免疫抑制微环境的形成,最终促进PTC的恶性进展。那么通过拮抗CXCR2或Gr-1抑制 MDSCs募集或活性可提高MAPKi等靶向药对肿瘤的杀伤作用,为促进PTC的临床治疗效果提供了新的方法。
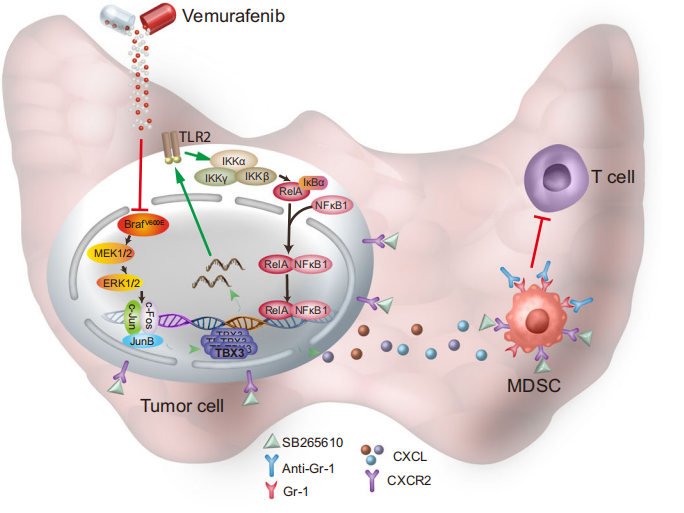
图4 BRAFV600E诱导的PTC发展过程中的关键分子级联反应模型:BRAF/MAPK的组成型激活重新激活TBX3,通过将MDSCs募集到肿瘤微环境中导致免疫抑制,以及使用PLX4032和SB265610或抗Gr-1联合治疗甲状腺癌
BRAFV600E的致癌作用已广为人知,该基因突变导致的肿瘤研究也有多方面的深入发展。在今年6月,FDA批准达拉非尼(Tafinlar)联合曲美替尼(Mekinist)的BRAF/MEK抑制剂组合疗法用于治疗在先前治疗后有进展且没有令人满意替代治疗方案的6岁及以上不可切除或转移性实体瘤BRAF V600E突变的成人和儿童患者。这是唯一获准用于儿童的BRAF/MEK抑制剂,是目前对于治疗BRAF V600E突变肿瘤较好的方案。
对于肿瘤的研究和治疗是一个艰难而漫长的过程,云克隆可为广大研究者提供相关产品,期望能为肿瘤的研究和治疗提供帮助。
指标 | 指标货号 |
B-Raf Proto Oncogene Serine/Threonine Protein Kinase (BRAF) | G347 |
Extracellular Signal Regulated Kinase 2 (ERK2) | A930 |
Colony Stimulating Factor 1, Macrophage (MCSF) | A090 |
Adenylate Kinase 2 (AK2) | C290 |
Fas Associating Death Domain Containing Protein (FADD) | K078 |
Androgen Receptor (AR) | B252 |
Testosterone (Testo) | A458 |
T-Box Protein 3 (TBX3) | H858 |
| Chemokine (C-X-C Motif) Ligand 1 (CXCL1) | A041 |
Chemokine (C-X-C Motif) Ligand 2 (CXCL2) | B603 |
Toll Like Receptor 2 (TLR2) | A663 |
Nuclear Factor Kappa B (NFkB) | B824 |
参考文献:
[1] Barceló, C., Sisó, P., de la Rosa, I. et al. M-CSF as a therapeutic target in BRAFV600E melanoma resistant to BRAF inhibitors. Br J Cancer (2022). https://doi.org/10.1038/s41416-022-01886-4
[2] Kim, H., Jeong, M., Na, DH. et al. AK2 is an AMP-sensing negative regulator of BRAF in tumorigenesis. Cell Death Dis 13, 469 (2022). https://doi.org/10.1038/s41419-022-04921-7
[3] Vellano, C.P., White, M.G., Andrews, M.C. et al. Androgen receptor blockade promotes response to BRAF/MEK-targeted therapy. Nature 606, 797–803 (2022). https://doi.org/10.1038/s41586-022-04833-8
[4] Zhang, P., Guan, H., Yuan, S. et al. Targeting myeloid derived suppressor cells reverts immune suppression and sensitizes BRAF-mutant papillary thyroid cancer to MAPK inhibitors. Nat Commun 13, 1588 (2022). https://doi.org/10.1038/s41467-022-29000-5