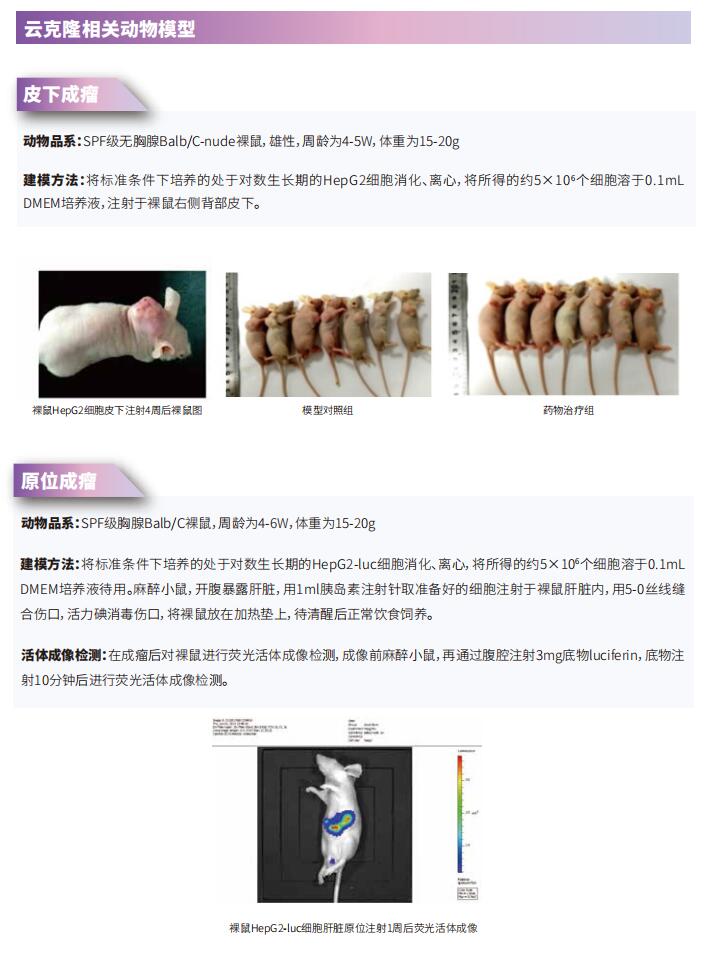
CAR-T治疗实体肿瘤研究新发现
嵌合抗原受体(CAR)-T细胞免疫疗法是近年来发展迅速的过继性免疫疗法。它是一种新型的治疗方法,使T细胞能够在其表面表达特定的CAR,然后将通过这些T细胞杀死相应的肿瘤细胞。CAR-T细胞免疫疗法在血液系统恶性肿瘤的治疗中显示出显著疗效,促进了其在实体瘤治疗中的应用。然而,与对血液系统恶性肿瘤的治疗效果相比,CAR-T细胞免疫疗法对实体瘤的总体疗效微不足道。因此,发掘CAR-T细胞免疫疗法在实体瘤的治疗中的巨大潜力,可为临床治疗提供新的思路和方法。
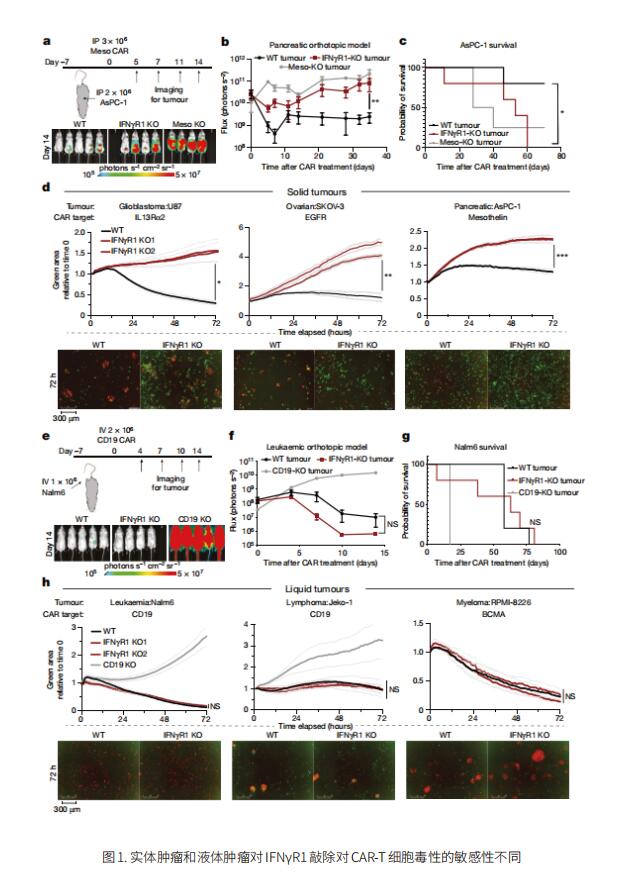
1. 在实体瘤中CAR-T细胞杀伤依赖IFNγR途径
实体肿瘤可能对CAR-T细胞的细胞毒性有细胞内在的耐药机制。美国麻省总医院癌症中心细胞免疫治疗计划Marcela V. Maus团队为了系统地识别潜在的耐药途径,在胶质母细胞瘤中进行了全基因组CRISPR敲除筛选[1]。他们发现干扰素-γ受体(IFNγR)信号通路(IFNGR1、JAK1或JAK2)中基因的缺失使胶质母细胞瘤和其他实体瘤在体外和体内都更能抵抗CAR-T细胞的杀伤(图1)。然而,这种途径的缺失并没有使白血病或淋巴瘤细胞系对CAR-T细胞不敏感(图1)。使用转录分析,他们确定缺乏IFNγR1的胶质母细胞瘤细胞在暴露于CAR-T细胞后细胞粘附途径的上调较低,降低了整体CAR-T细胞结合持续时间和亲和力。因此,在胶质母细胞瘤肿瘤中,IFNγR信号是CAR-T细胞充分粘附以介导产生性细胞毒性所必需的。这项工作表明,液体和实体肿瘤与CAR-T细胞的相互作用不同,并表明增强 T 细胞和肿瘤细胞之间的结合相互作用可能会改善实体瘤的反应。
2. 表达细菌毒力因子的CAR-T细胞在实体癌中引发有效的旁观者抗肿瘤效应
在实体肿瘤中,CAR-T细胞的效力被局部免疫抑制和CAR靶向抗原的异质表达所阻碍。瑞典免疫学系乌普萨拉大学免疫学系Magnus Essand证明CAR-T细胞表达一种来自幽门螺杆菌的多能促炎中性粒细胞激活蛋白(NAP)时,可以触发内源性的旁观者T细胞对实体癌症的反应[2]。在皮下小鼠胰腺导管腺癌、神经母细胞瘤或结肠癌小鼠中,CAR(NAP)-T细胞比传统小鼠CAR-T细胞导致肿瘤生长缓慢并具有更高的生存率。在具有异质抗原表达的肿瘤中,NAP的分泌支持树突状细胞成熟和旁观者效应,如表位扩散和细胞毒性CD8+ T细胞的浸润靶向肿瘤相关抗原(图2)。配备NAP的CAR-T细胞既不会增加肿瘤外毒性,也不会阻碍CAR-T细胞的功效,因此可能具有有利的转化潜力。

3. 针对低抗原密度调整的GPC2-CAR T细胞介导对神经母细胞瘤的有效活性而无毒性
儿科癌症通常模仿胎儿组织并表达在出生后沉默的蛋白质,而这些蛋白质可以作为免疫靶点。美国斯坦福大学医学院癌症细胞治疗中心Crystal L. Mackall团队开发了一种靶向 glypican-2 (GPC2)(在神经母细胞瘤(NB)和其他几种实体瘤上表达的胎儿抗原)的CAR-T细胞[3]。使用流式细胞术测量小儿骨髓样本中转移性NB上的GPC2抗原密度,他们证明临床样本中的GPC2抗原密度低于控制传统设计的GPC2-CAR-T细胞肿瘤生长所需的阈值。通过跨膜和共刺激结构域的迭代工程加上c-Jun的过表达降低了GPC2-CAR抗原密度阈值,从而能够有效且持久地根除表达临床相关GPC2抗原密度的NB,并且没有毒性(图3)。这项工作验证了下一代CAR工程可以调节抗原密度阈值并提供能够靶向表达在实体瘤上的非突变、非谱系细胞表面抗原同时保留正常组织的治疗方法。

参考文献
[1]Larson RC, Kann MC, Bailey SR, et al. CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours[J]. Nature. 2022, 604(7906):563-570. (IF=69.502)
[2]Jin C, Ma J, Ramachandran M, Yu D, Essand M. CAR T cells expressing a bacterial virulence factor trigger potent bystander antitumour responses in solid cancers[J]. Nat Biomed Eng. 2022, 6(7):830-841. (IF=29.235)
[3]Heitzeneder S, Bosse KR, Zhu Z, et al. GPC2-CAR T cells tuned for low antigen density mediate potent activity against neuroblastoma without toxicity[J]. Cancer Cell. 2022, 40(1):53-69.e9. (IF=38.583)
云克隆不仅可提供多种肿瘤实验动物模型,包括肿瘤移植动物模型、自发性肿瘤动物模型、诱发性肿瘤动物模型、肿瘤转移动物模型等,涵盖常见肿瘤研究。还具有各类癌症检测指标及上述IFNγR信号通路和GPC2相关产品,可助力广大科研工作者进行癌症相关研究。