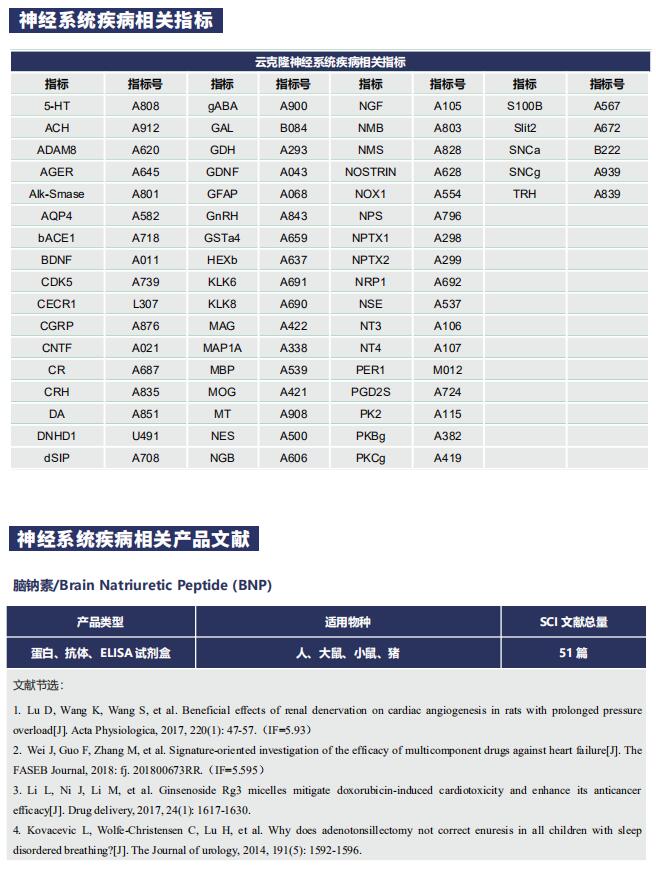
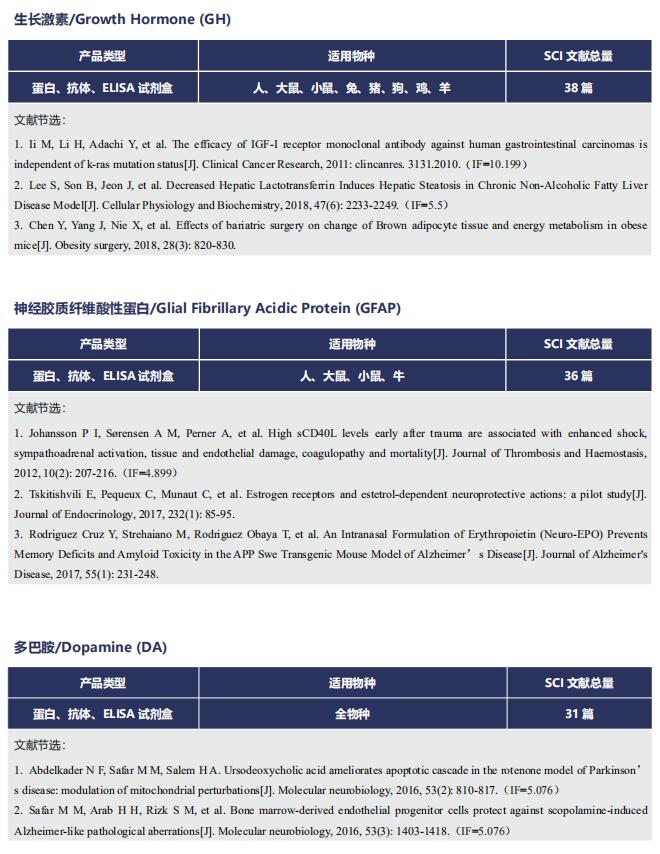
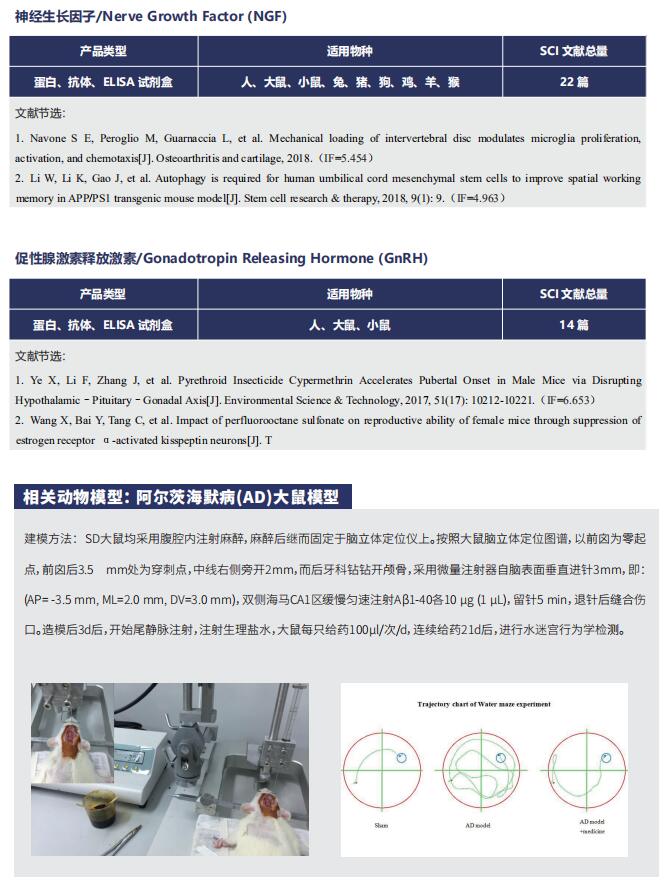
文献解读 | Angiopep-2和TAT肽双功能化的工程细胞外囊泡的特异性抗胶质瘤靶向递送策略

2022年8月6日,中国科学技术大学纳米技术与纳米仿生学院Guosheng Cheng团队在《Journal of Extracellular Vesicles》上发表题为“Specific anti-glioma targeted-delivery strategy of engineered small extracellular vesicles dual-functionalised by Angiopep-2 and TAT peptides”的文章。他们开发了一种双重修饰的小细胞外囊泡的药物输送策略,对治疗中枢神经系统疾病具有很大的前景。

在这篇文章中,云克隆试剂盒【肌酸激酶MB同工酶(CKMB)检测试剂盒(酶联免疫吸附试验法),SEA479Mu;天冬氨酸转氨酶(AST)检测试剂盒(酶联免疫吸附试验法),SEB214Mu】受到科研工作者的认可,荣登优秀国际期刊。



研究简介
神经胶质瘤是一种常见于中枢神经系统神经胶质组织的恶性肿瘤。由于高侵袭性、快速生长和增强的血管生成,胶质瘤无法通过常规手术进行完全切除,导致预后不良和生存时间短。然而,胶质瘤细胞对化疗和放疗存在内在障碍,同时存在血脑屏障和肿瘤屏障两种生物屏障,严重阻碍了几乎所有大分子和98%小分子药物进入肿瘤区域。小细胞外囊泡(sEV)最近作为一种新的递送系统出现,可以有效地跨越这些生物屏障并被设计用于精准医学。
Angiopep-2(Ang)是一种对低密度脂蛋白受体相关蛋白-1具有高亲和力的活性靶肽,具有脑穿透能力。转录反式激活因子(TAT)肽是一种有效的细胞穿透肽,它可以穿透质膜以及大多数活细胞的核包膜。作者团队生成了双肽修饰的功能性sEV (Ang/TAT-sEVs-Dox) 作为一种高效的递送系统。通过Ang和TAT的协同作用,双肽修饰的sEV不仅可利用TAT介导的高效细胞膜穿透和Ang介导的对胶质瘤的靶向能力,也能克服Ang受体饱和现象。因此,该系统可渗透血脑屏障并穿透肿瘤。作者分别在体外单层培养细胞和血脑屏障模型中评估了工程sEV在靶向血脑屏障和神经胶质瘤方面的高效率。在皮下肿瘤和原位神经胶质瘤小鼠模型中重新验证了观察到的高靶向效率。在将多柔比星加载到双重修饰的功能性sEV中后,这种特定的双靶向递送系统可以穿过血脑屏障,到达神经胶质瘤并穿透肿瘤。最后,作者通过使用这种药物递送模式显著提高了胶质瘤小鼠的存活时间。
综上所述,Ang和TAT双肽修饰的sEV是一种简单且天然的纳米级药物递送平台,可高效地将化疗药物靶向小鼠大脑。这种独特的工程化sEV在治疗胶质瘤方面具有巨大潜力,并有望成为未来治疗中枢神经系统疾病的策略。