干燥综合征研究新进展
干燥综合征(SS)是一种自身免疫性疾病,其特征在于外分泌腺的慢性炎症和针对核糖核蛋白颗粒SSA/Ro和SSB/La的自身抗体的存在。临床特征是眼睛干涩(干燥性角膜结膜炎)和口干。由于其他器官受累,SS也有多种全身表现。尽管SS可能涉及环境和遗传因素的组合,但人们对导致该疾病的致病机制知之甚少。由于病因不明,SS仅存在姑息治疗,未能改善SS患者的生活质量。更好地了解病理生理学对于开发一种改善SS的疾病治疗方法至关重要。
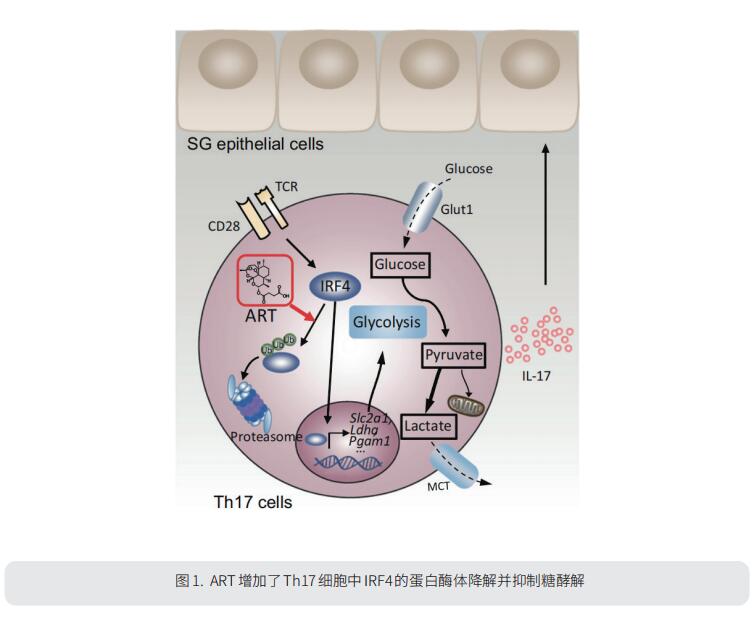
1. 青蒿琥酯通过抑制IRF4介导的糖酵解抑制Th17反应并改善SS
Th17细胞被认为是SS疾病发生和延续的关键驱动因素。先前的研究表明,青蒿素的重要衍生物青蒿琥酯(ART)可调节关节炎大鼠的Th17和调节性T(Treg)细胞平衡。香港大学深圳医院病理学系LiweiLu团队探讨ART对SS疾病发展的作用[1]。在诱导实验性SS的小鼠中,ART的施用显著降低了SS疾病进展过程中包括抗SSA IgG在内的自身抗体的血清水平,减少了Th17细胞,减轻了唾液腺炎症。IRF4是T细胞分化和功能的关键调节因子。在Th17细胞中,Glut1的水平与IRF4表达相关。ART治疗显著降低了人和鼠Th17细胞中的IRF4水平。机制分析显示,ART显著增加了连锁特异性K48泛素的水平,该泛素主要靶向IRF4+Th17细胞中蛋白酶体降解的蛋白质。这提示ART通过促进IRF4的蛋白酶体降解来抑制Th17糖酵解的新代谢调节功能(图1)。综上所述,这些发现表明ART可能作为SS的潜在治疗药物。
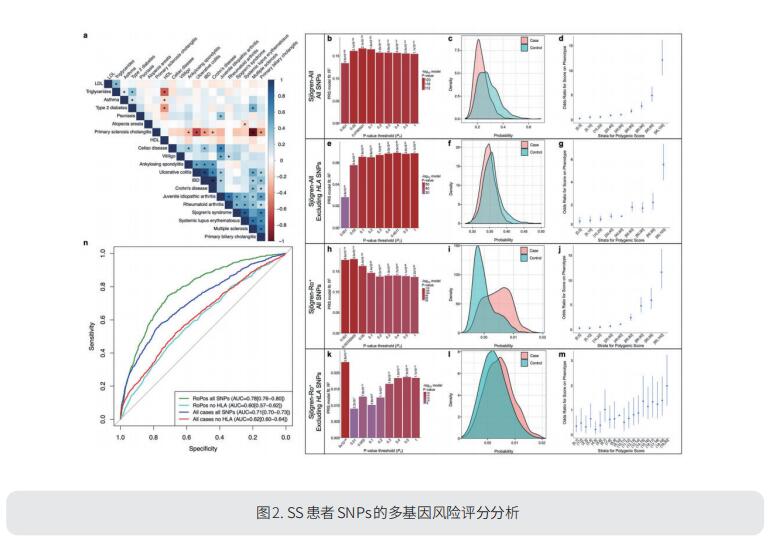
确定SS的遗传风险将为了解影响疾病发病机制的失调分子机制提供重要见解,并促进新治疗方法的开发以改善早期诊断和治疗。美国基因和人类疾病研究计划俄克拉荷马医学研究基金会ChristopherJ.Lessard团队对欧洲血统的SS患者进行了迄今为止最大的GWAS研究,从而确定了10个新的GWS关联基因:CD247、NAB1、PTTG1-MIR146A、PRDM1-ATG5、TNFAIP3、XKR6、MAPT-CRHR1、RPTOR-CHMP6-BAIAP6、TYK2、SYNGR1[2]。使用基因分型的SNP,他们还评估了与相关自身免疫疾病的遗传相关性以及多基因风险评分分析预测疾病的能力(图2)。在免疫细胞类型特异性eQTLs的背景下评估每个区域的局部调控网络显示,大多数区域具有广泛的调控网络,共同涉及索引基因上游和下游的>40个基因。此外,这些扩展的局部调节网络中基因的通路分析具有不同的功能潜力,并且可能通过改变细胞功能来影响疾病的发病机制。
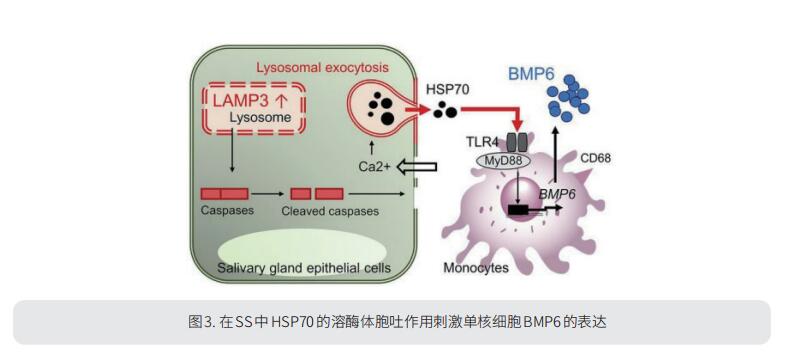
3. 在SS中HSP70的溶酶体胞吐作用刺激单核细胞BMP6的表达
BMP6是诱导SS相关分泌功能减退的中心细胞因子。美国国立卫生研究院AAV生物学研究室JohnA.Chiorini团队对取自SS患者的唾液腺切片的分析表明单核细胞系细胞是BMP6的细胞来源[3]。人类唾液腺的RNA-Seq数据表明,TLR4信号传导是BMP6的上游调节因子。进一步研究表明,HSP70是一种内源性天然TLR4配体,可刺激SS中的BMP6表达。上皮细胞释放HSP70可能是由溶酶体相关膜蛋白3(LAMP3)的过表达触发的,该蛋白在多项转录组研究中也与SS相关。体外研究支持这一观点,即HSP70是由于LAMP3表达引发的溶酶体胞吐作用而释放的,并且对来自SS患者小唾液腺的RNA的逆转录PCR证实了BMP6和LAMP3表达之间的正相关。BMP6的表达可以通过LAMP3的过表达在小鼠中实验性地诱导,从而形成SS样表型。新发现的LAMP3/HSP70/BMP6轴为SS腺体功能障碍和自身免疫提供了病因模型(图3)。
4. 体内产生SSA/Ro抗原特异性调节性T细胞可改善小鼠的实验性SS
T细胞在SS疾病的发生和持续发展中起重要作用。美国国立卫生研究院口腔与颅面研究所粘膜免疫学研究室WanJunChen团队通过将CD4+T细胞的瞬时耗竭与自身抗原特异性肽Ro480的施用相结合,开发了一种用于SS样NOD/Ltj小鼠的免疫疗法[4]。NOD/Ltj小鼠用单抗CD4mAb治疗,2天后每隔一天连续6次注射Ro480-494。anti-CD4mAb与自身抗原特异性肽Ro480联合在体内产生SSA/Ro抗原特异性调节性T细胞,可抑制唾液腺中CD4+T细胞产生IFN-γ和炎症浸润,维持唾液腺功能(图4)。这项研究结果提供了一种在体内产生用于SS治疗的抗原特异性调节性T细胞的新方法,可能对SS患者的潜在治疗产生影响。

参考文献
[1]Xiao F, Rui K, Han M, et al. Artesunate suppresses Th17 response via inhibiting IRF4-mediated glycolysis and ameliorates Sjog̈ren's syndrome. Signal Transduct Target Ther. 2022;7(1):274.(IF=38.104)
[2]Khatri B, Tessneer KL, Rasmussen A, et al. Genome-wide association study identifies Sjögren's risk loci with functional implications in immune and glandular cells. Nat Commun. 2022;13(1):4287. (IF=17.694)
[3]Mo YQ, Nakamura H, Tanaka T, et al. Lysosomal exocytosis of HSP70 stimulates monocytic BMP6 expression in Sjögren's syndrome. J Clin Invest. 2022;132(6):e152780.(IF=19.456)
[4]Xu J, Liu O, Wang D, et al. In vivo generating SSA/Ro-antigen specific regulatory T cells improves experimental Sjögren's syndrome in mice. Arthritis Rheumatol. 2022;10.1002/art.42244. (IF=15.483)
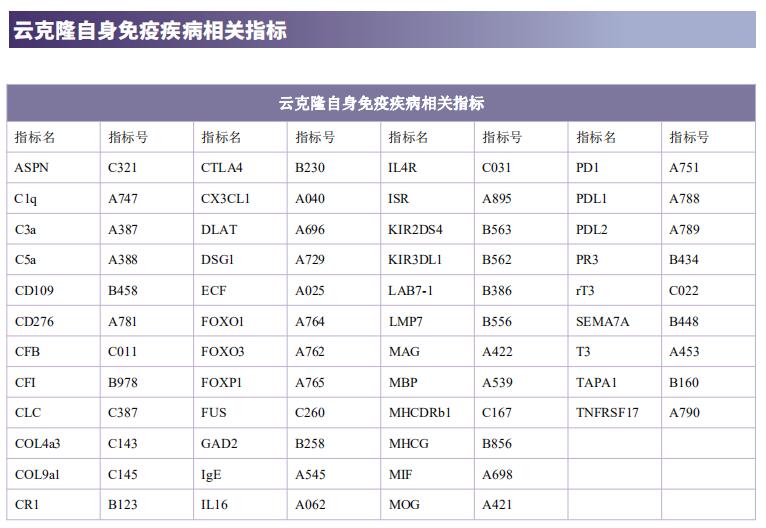
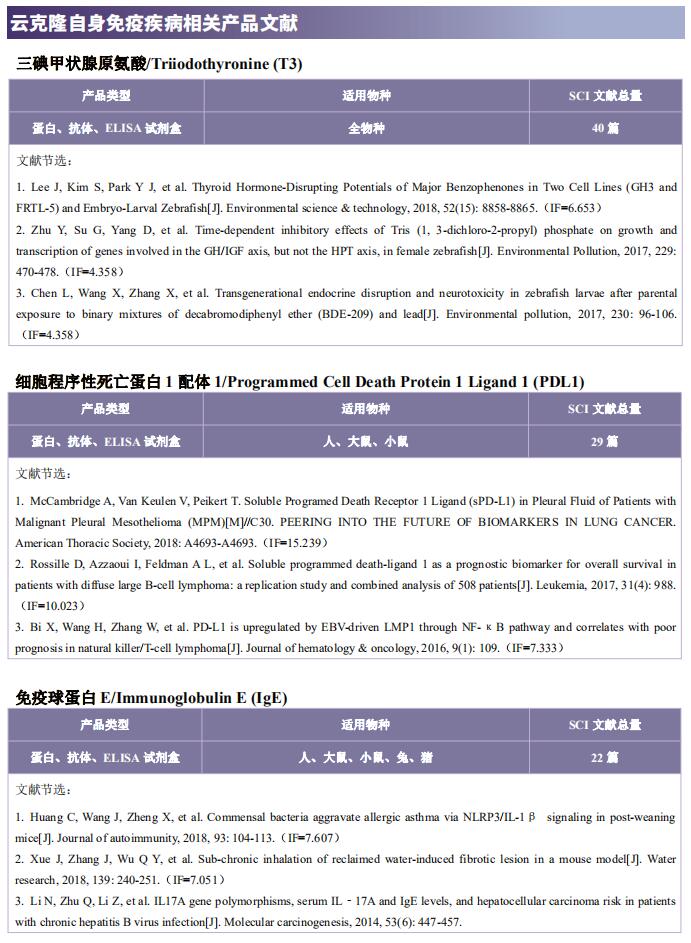
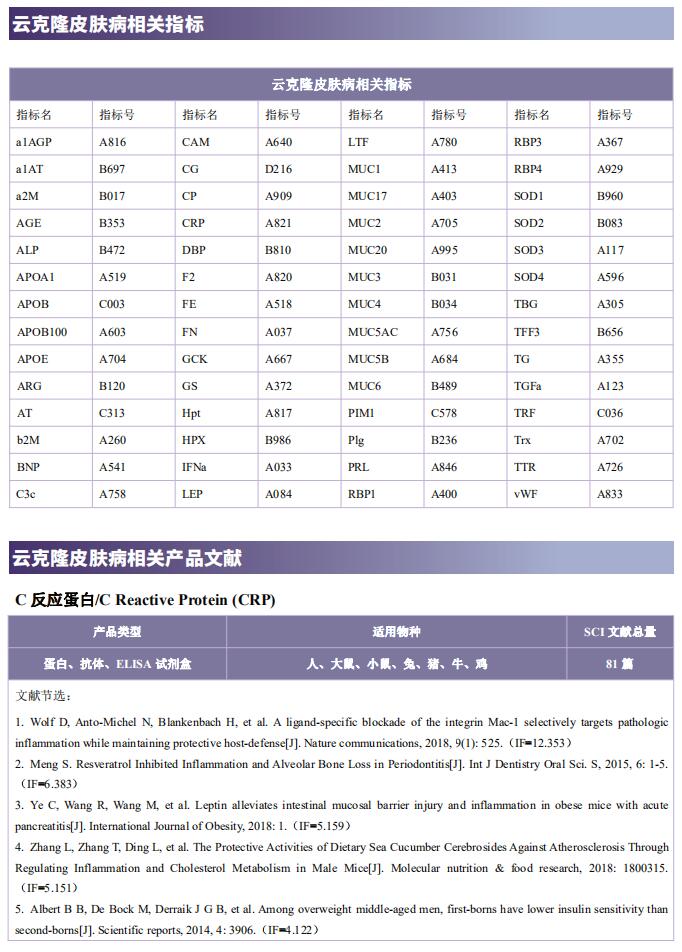
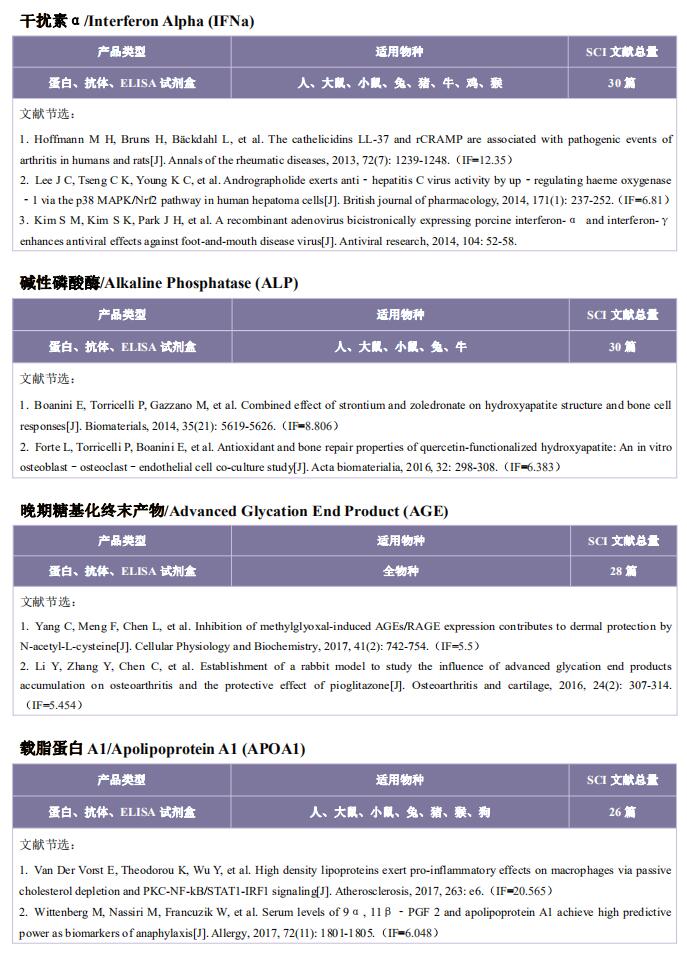
云克隆不仅可提供多种自身免疫疾病动物模型,包括干燥综合征、系统性红斑狼疮、类风湿性关节炎、银屑病等,涵盖常见自身免疫疾病;还具有各类自身免疫疾病检测指标及上述SSA、SSB、IRF4、Glut1、BMP6、TLR4、LAMP3、HSP70等相关产品,可助力广大科研工作者进行自身免疫疾病研究。