文献解读 | 新型去铁胺化合物有效螯合过量铁以治疗铁超载障碍和预防铁死亡

2022年8月28日,中国科学院生态环境科学研究中心环境化学与生态毒理学国家重点实验室Sijin Liu团队在《Advanced Science》上发表题为“New Deferric Amine Compounds Efficiently Chelate Excess Iron to Treat Iron Overload Disorders and to Prevent Ferroptosis”的文章,他们发现一种新的去铁胺化合物可以通过调节驱动脂质过氧化的细胞内信号来抑制铁诱导的铁死亡。

在这篇文章中,云克隆试剂盒【β2-微球蛋白(b2M)检测试剂盒(酶联免疫吸附试验法),SEA260Mu】受到科研工作者的认可,荣登优秀国际期刊。


作为一种关键的辅因子,铁参与了许多基本的生化过程。然而,过量的铁是有害的,因为氧化应激会导致细胞损伤,甚至导致铁依赖性细胞死亡,即铁死亡。使用铁选择性螯合剂的治疗干预是去除过量铁的一种至关重要的策略。目前的铁螯合剂包括去铁胺、去铁酮和地拉罗司,但这些药物都因为各种不良反应限制了其广泛应用。因此迫切需要开发具有更大疗效和更低毒性的新型螯合剂以治疗铁过载紊乱相关疾病。
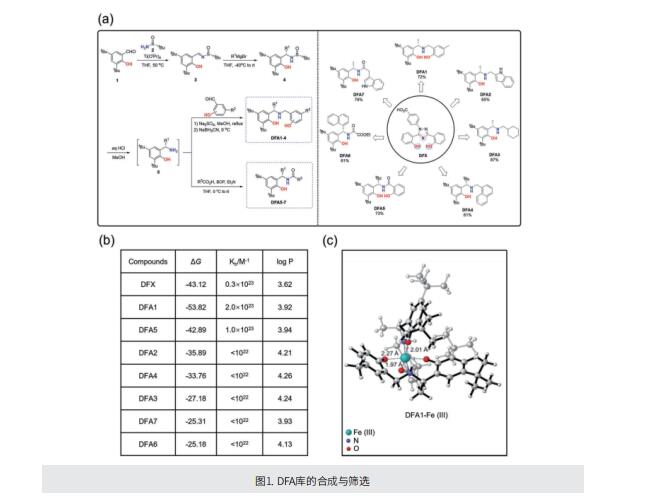
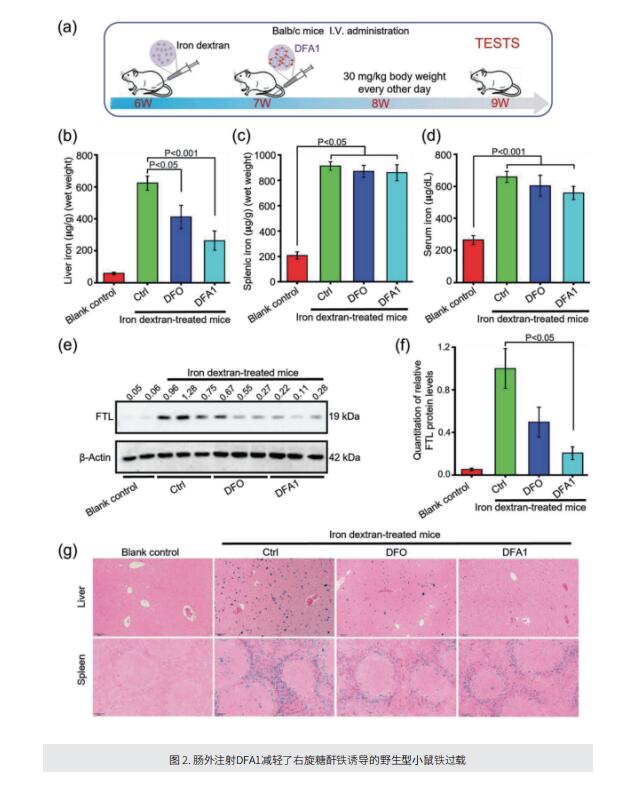
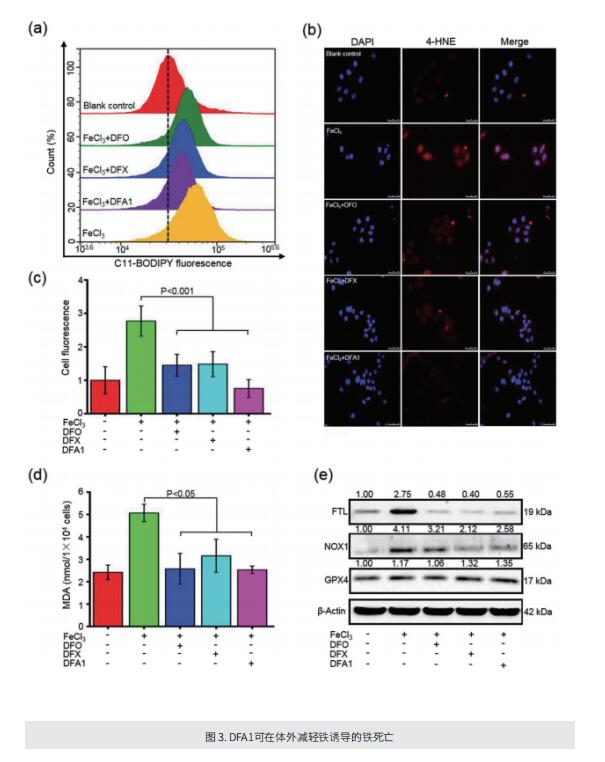
考虑到当前铁螯合剂的结构属性和实际限制,作者设计了一个具有可调节骨架和柔性的新型去铁胺化合物(DFA)库,其中苯酚部分的取代基将防止其氧化为醌。DFA中的氧和氮赋予O,N,O-Fe络合物中与铁的高度稳定结合。筛选后,文库中的化合物DFA1在体外和体内螯合过量铁方面表现出显著的效果,甚至比常规螯合剂更有效。该化合物通过口服和静脉给药,显著改善了不同小鼠模型中的铁过载,包括血色素沉着症、高铁饮食诱导和铁葡聚糖刺激的铁积累。此外,化合物DFA1还减轻静脉和口服给药后螯合剂相关的不良反应。进一步分析显示,化合物DFA1可以通过调节驱动脂质过氧化的细胞内信号来抑制铁诱导的铁死亡。
综上所述,作者设计了具有可调骨架和配铁灵活性的新型DFA。酚羟基中的两个分子氧原子和胺中的氮原子在螯合铁中起着关键作用。DFA1在体外和小鼠铁超载模型中有效去除过量铁,在改善铁相关损伤方面表现出显著疗效。这项研究为开发铁螯合剂治疗铁过载开辟了一条新途径。
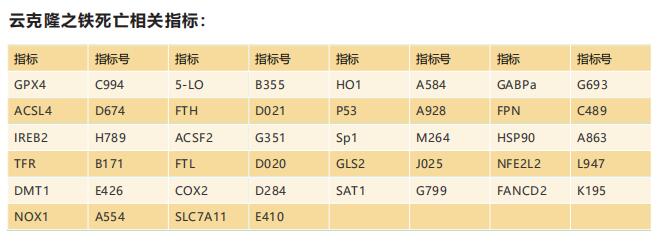
铁死亡—细胞程序性死亡的新热点
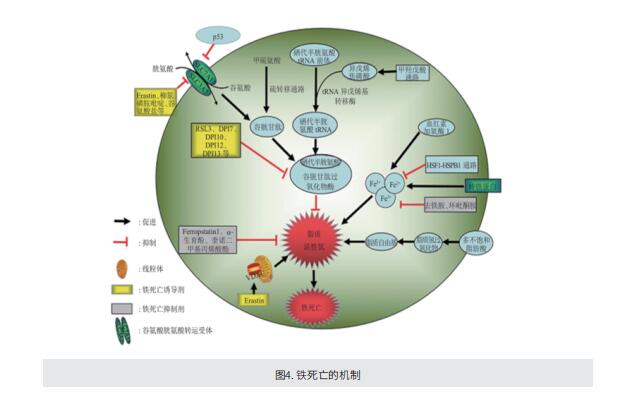
细胞死亡是所有细胞最终的宿命,细胞死亡的方式是生物医学领域的重大研究热点。我们以前为大家介绍过细胞焦亡,那么,细胞程序性死亡除了细胞凋亡、细胞焦亡等方式之外,还有没有其他的死亡方式呢?2012年,“铁死亡”的概念首次由Brent R. Stockwell团队提出。铁死亡(ferroptosis)是在小分子物质诱导下发生的氧化性细胞死亡,具有铁离子依赖性。其发生是细胞内脂质活性氧(reactive oxygen species,ROS)生成与降解的平衡失调所致。铁死亡诱导剂通过不同的通路直接或间接作用于谷胱甘肽过氧化物酶((glutathione peroxidase,GPXs),导致细胞抗氧化能力降低、ROS堆积,最终引起的细胞氧化性的、非细胞凋亡形式的细胞死亡。
铁死亡发生的机制
1.抑制GPX4: GPX4能抑制脂质过氧化,若细胞中GPX4表达下调,铁死亡则更易发生。
2.抑制胱氨酸谷氨酸转运受体:谷氨酸的水平会影响到胱氨酸谷氨酸转运受体的功能,细胞外高浓度的谷氨酸会抑制胱氨酸谷氨酸转运受体从而诱导铁死亡。
3.p53的介导:p53通过下调胱氨酸谷氨酸转运受体组分SLC7A11的表达抑制细胞对胱氨酸的摄取,导致谷胱甘肽过氧化物酶活性降低,削减细胞抗氧化能力,增强细胞对铁死亡的敏感性。
铁死亡与人类疾病
1.铁死亡与肿瘤一般我们认为,p53通过诱导细胞衰老程序性死亡从而抑制肿瘤。最近研究表明,p53在正常细胞中可以负调控脂质合成和糖降解,正调控氧化磷酸化和脂质分解代谢,而在肿瘤细胞中突变型的p53正调控脂质的合成和糖酵解,已有研究发现,肾癌、白血病对铁死亡敏感。GPX4可以发挥脂质抗氧化剂的作用,有一些靶向GPX4的药物,但是大多数癌症仍然对铁死亡有抵抗力。
2.铁死亡与肝损伤铁死亡具有铁依赖性,可被铁螯合剂所特异性逆转,那铁过载是否会导致铁死亡呢?有研究通过高铁蓄积的基因敲除小鼠模型研究的过多铁储存于肝脏,会导致组织器官退行性病变,引发肝损伤(可参考云克隆肝缺血再灌注动物模型:DSI527Mu01,DSI527Ra01)。
3.铁死亡与心脏损伤通过小鼠心肌缺血再灌注(I/R)损伤模型(可参考云克隆心肌梗死动物模型:DSI504Mu01,DSI504Ra02),同样发现铁死亡的存在。给予铁死亡抑制剂阻断铁死亡可明显减轻缺血再灌注导致的急性和慢性心脏损伤,为临床上心肌梗死等心脏疾病提供了非常有前景的新思路和策略。