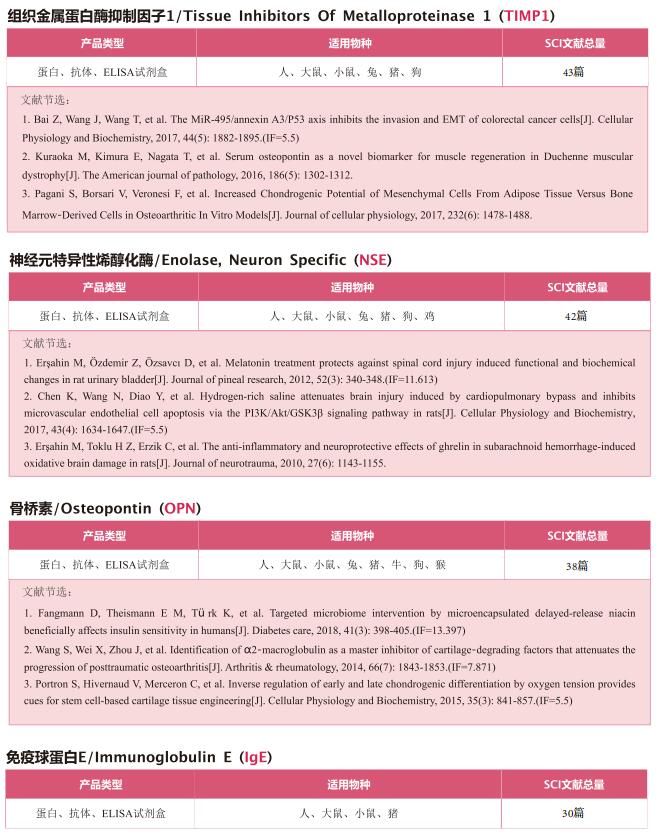
文献解读 | 胶质母细胞瘤干细胞特异性组胺分泌驱动促血管生成的肿瘤微环境重构

2022年10月19日,上海复旦大学基础医学院Xin Pan团队在《Cell Stem Cell》上发表题为“Glioblastoma stem cell-specific histamine secretion drives pro-angiogenic tumor microenvironment remodeling”的文章,他们的发现胶质母细胞瘤干细胞(GSC)特异性代谢物分泌重塑了肿瘤微环境,并强调靶向组胺可能是多形性胶质母细胞癌(GBM)治疗的潜在策略。

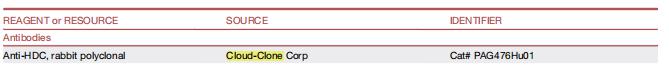
在这篇文章中,云克隆抗体【组氨酸脱羧酶(HDC)多克隆抗体,PAG476Hu01】受到科研工作者的认可,荣登优秀国际期刊。

多形性胶质母细胞瘤(GBM)是成人最常见和最具侵袭性的原发性脑癌。即使采用了最佳的治疗方法(包括手术、放疗和化疗),GBM患者的预后仍然很差。GBM含有被称为胶质母细胞瘤干细胞(GSC)的侵袭性肿瘤细胞群。GSC具有自我更新和分化的能力,并对肿瘤的进展、复发、耐药性和转移有重要作用。对这种独特的细胞亚群的生物学进行全面了解可能为开发GBM的疗法提供新的方向。
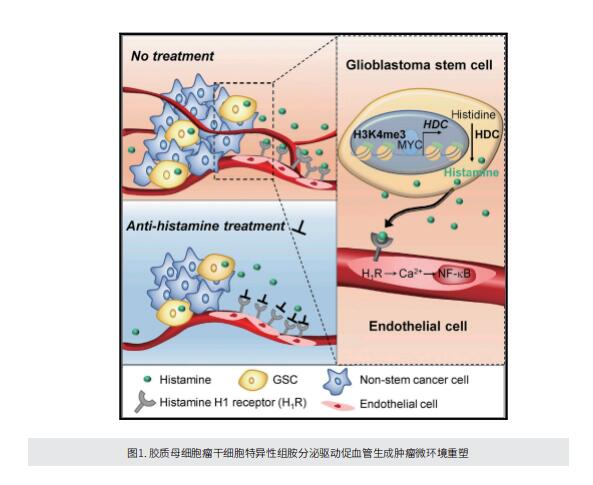
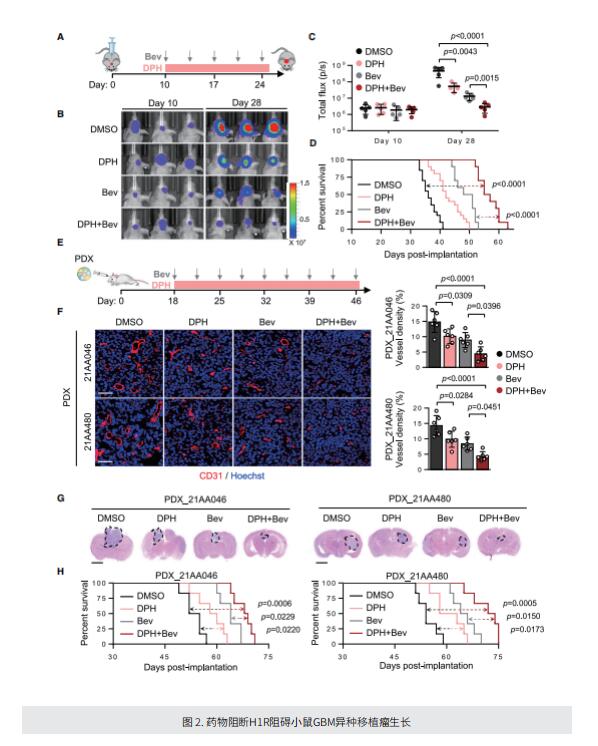
在这项研究中,作者通过代谢组学方法分析GSC优先分泌的代谢物,发现GSC产生和分泌组胺,以形成促进血管生成的肿瘤微环境。他们证明GSC的这一特征是通过在组氨酸脱羧酶(HDC,编码组胺合成酶的基因)位点上GSC特异性的H3K4me3修饰,由MYC介导的HDC的转录上调而实现的。值得注意的是,HDC在GBM中高度表达,这与GBM患者的不良生存率有关。GSC分泌的组胺通过触发组胺H1受体(H1R)-Ca2+-NFkB轴激活内皮细胞,从而促进血管生成和GBM进展。使用抗组胺药物对H1R的药物阻断阻碍了GBM异种移植物在小鼠体内的生长。
综上所述,作者的发现揭示了GSC的整合转录、表观遗传和代谢调节改变肿瘤微环境的机制,并强调了靶向组胺作为GBM治疗的潜在策略。