文献解读 | RAB22A介导的非典型自噬激活STING的细胞间转移促进抗肿瘤免疫

2022年10月24日,中山大学肿瘤中心Tiebang Kang团队在《Cell Research》上发表题为“Intercellular transfer of activated STING triggered by RAB22A-mediated non-canonical autophagy promotes antitumor immunity”的文章,报道了活化的STING可以在细胞间转移以促进抗肿瘤免疫,这一过程由RAB22A介导的非典型自噬引发。

在这篇文章中,云克隆试剂盒【跨膜蛋白173(TMEM173)检测试剂盒(酶联免疫吸附试验法,高敏型),HEN011Hu】受到科研工作者的认可,荣登优秀国际期刊。


cGAS-STING信号通路在先天免疫中起着重要作用。STING是一种内质网跨膜蛋白,由cGAS产生的天然配体cGAMP激活,cGAMP招募TANK结合激酶1(TBK1),通过磷酸化激活干扰素调节因子3(IRF3),进而诱导各种细胞因子的产生。然而,如何更好地利用STING途径作为治疗靶点仍然是一个挑战。
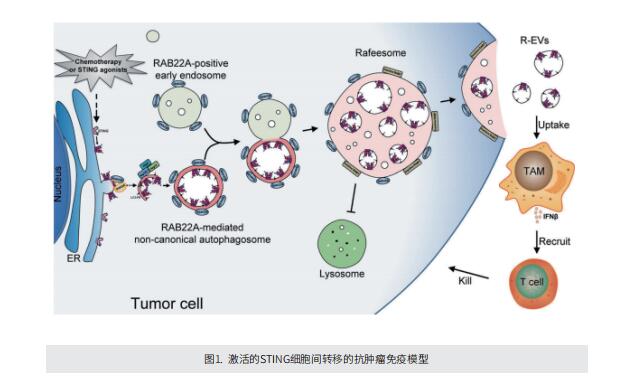
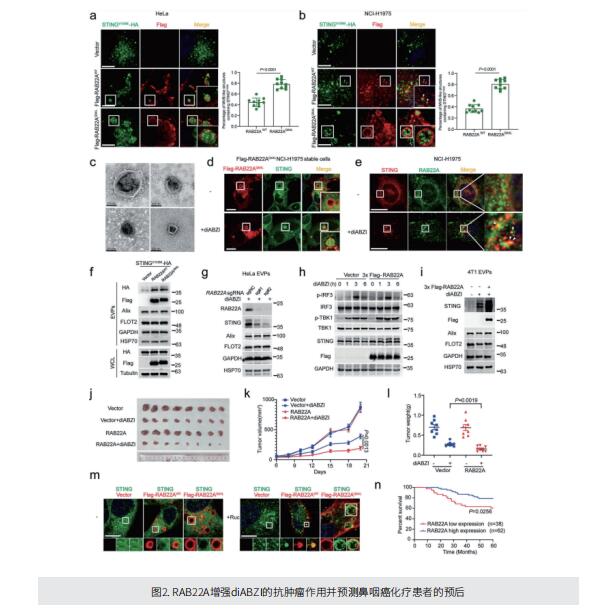
在这项研究中,作者报道了活化的STING可以在细胞间转移以促进抗肿瘤免疫,这一过程由RAB22A介导的非典型自噬引发。从机制上讲,RAB22A与PI4K2A结合产生PI4P, PI4P募集Atg12-Atg5-Atg16L1复合体,诱导内质网衍生的RAB22A介导的非典型自噬体形成,其中封装有激动剂或放化疗激活的STING。这种RAB22A诱导的自噬体与RAB22A阳性的早期内体融合,产生了一种新的细胞器,称之为Rafeesome(RAB22A介导的与早期内体结合的非典型自噬体)。同时,RAB22A使RAB7失活,以抑制Rafeesome与溶酶体的融合,从而使携带活化STING的自噬体的内囊泡分泌成为一种新的细胞外囊泡(EV),作者将其定义为R-EV(RAB22A诱导的细胞外囊泡)。激活的含有STING的R-EV诱导IFNβ从受体细胞释放到肿瘤微环境,促进抗肿瘤免疫。RAB22A可以增强STING激动剂diABZI在小鼠体内的抗肿瘤作用,RAB22A水平高预示着鼻咽癌放化疗患者的良好生存率。这些结果表明Rafeesome调节激活的STING的细胞间转移,以触发和传播抗肿瘤免疫。
综上所述,我们定义了一种新的细胞器Rafeesome,通过它,RAB22A介导的携带活化STING的非典型自噬体的内囊泡被转移并最终分泌为R-EV,这是一种在受体细胞中触发抗肿瘤免疫的新型EV。这项工作提供了Rafeesome调节内质网蛋白STING细胞间转移的证据,以及源于内质网的自噬体内囊泡作为一种新型EV被分泌的证据,为理解细胞器膜蛋白的细胞间通信提供了新的视角。