探讨衰老相关疾病,迎接重度老龄化(二)
根据《“十四五”国民健康规划》展望,到2035年我国人均预期寿命将达到80岁以上,那么老年期阶段在人生历程中所占比重将会越来越高。在衰老的过程中,多种与年龄相关疾病的易感性增加。其中,认知功能下降、认知功能障碍已成为危害老年人健康和生活的主要问题之一,而睡眠则是影响老年人认知功能的关键因素之一。前期介绍了衰老与神经退行性疾病(如阿尔茨海默症、帕金森等)之间的作用关系,本文我们将介绍衰老与睡眠障碍之间的关系。
1 老化的下丘脑泌素/食欲素(Hcrt/OX)神经元过度兴奋致使睡眠碎片化
人类睡眠质量会随着年龄的增长而下降,然而,关于衰老如何影响睡眠质量的潜在机制仍然难以捉摸。斯坦福大学 Luis de Lecea 实验室在《Science》期刊发表了一篇探究“睡眠碎片化”背后神经机制的研究论文。该研究认为,在衰老过程中,过度兴奋的Hcrt/OX神经元会导致睡眠碎片化。尽管老年小鼠促醒Hcrt神经元数量减少,但为了维持原有的功能,该神经元会增加自身的放电频率,补偿性地提高兴奋性,故老化的Hcrt神经元表现出更频繁的神经元活动期。当Hcrt神经元过度兴奋时,KCNQ2表达降低,由KCNQ2/3通道介导的M电流减弱,从而阻碍神经元的复极,导致老年小鼠睡眠不稳定(见图1)。当破坏幼年小鼠Hcrt神经元中KCNQ2/3基因时,幼年小鼠也表现出睡眠碎片化现象。该研究阐明了老龄化过程中出现睡眠碎片化的一个机制:年老的Hcrt神经元有着更低的兴奋性阈值,从而导致睡眠失稳。
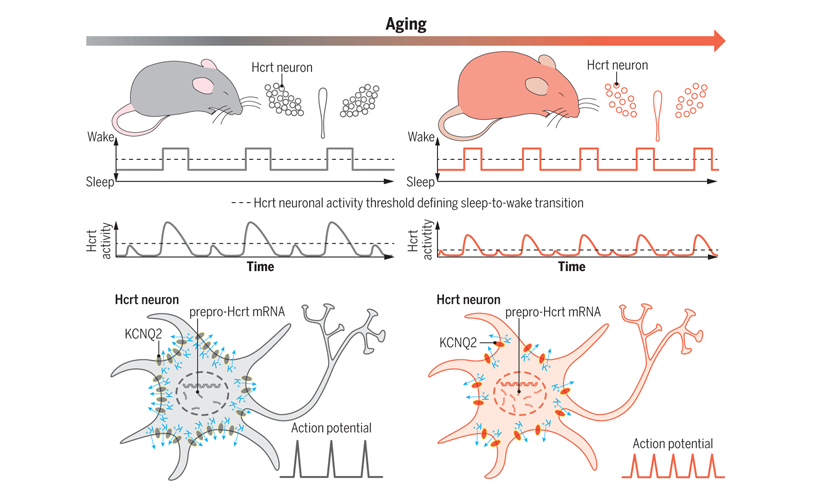
图1 高兴奋性Hcrt神经元在衰老过程中驱动睡眠不稳定
(图片源自《Science》杂志)
2 衰老增加内质网应激水平影响睡眠质量
随着年龄的增长,缓解细胞压力和确保蛋白质正确折叠的分子机制渐渐变得不再稳定有效,而内质网中未折叠的分泌蛋白积累(即内质网应激)对真核细胞有害,并促进未折叠的蛋白反应(UPR)。有研究认为,在衰老过程中,内质网应激增加和慢性PERK激活与睡眠和觉醒质量差有关。通过实验发现,与年轻小鼠比较,老年小鼠大脑皮层和海马区显示出更多的内质网应激和UPR活性,呈现更多的碎片化睡眠和觉醒,认知功能下降。4-苯基丁酸酯(PBA)作为化学分子伴侣,可通过恢复内质网功能,减轻内质网应激。给老年小鼠服用PBA后,觉醒次数减少,非快速眼动(NREM)睡眠和快速眼动(REM)睡眠次数都减少,但NREM时间延长,即老年小鼠睡眠质量得到提升(见图2),认知功能也得到改善,内质网应激减轻,UPR信号传感器PERK和ATF4激活减少,AKT和CREB活性水平升高。这些结果表明,减轻内质网应激,恢复蛋白质平衡可以改善衰老小鼠的睡眠和认知能力。

图2 PBA改善老年小鼠睡眠
(图片源自《Aging Cell》杂志)
3 炎症标志物激活诱导年龄相关睡眠障碍
现有研究表明,在被睡眠剥夺的健康成年人体内,单核细胞产生的促炎细胞因子(如:IL-6、TNF-α等)水平升高,炎症反应相关途径(如:NF-κB/Rel家族)被激活。实验性睡眠缺失会促进一种促炎转录基因表达谱激活,该表达谱激活与炎症相关疾病的风险增加有关。睡眠障碍包括主观睡眠质量差和失眠障碍,有研究发现在内毒素刺激下,主观睡眠差的老年人单核细胞产生IL-6和TNF-α的水平显著高于主观睡眠质量好的老年人;患有失眠障碍的老年人表现出更高水平的免疫激活和交感神经系统功能相关的转录因子活性(即NF-κB/Rel家族、CREB)。该研究结果提示,自然发生的睡眠障碍与老年人单核细胞产生的促炎细胞因子增加及炎症转录基因表达谱激活有关。
总而言之,衰老破坏机体内环境平衡,导致老年人睡眠障碍,但其机制和涉及的分子中间体在很大程度上是未知的。人一生中有三分之一的时间是在睡眠中度过,睡眠是机体复原、整合和巩固记忆的重要环节,因此,好的睡眠质量对人的身心健康有着至关重要的作用。探讨老年人睡眠障碍机制,对于抗衰老并维持健康老年生活具有重大意义。
睡眠剥夺是研究睡眠功能与发生机制的重要方法,云克隆可提供睡眠剥夺动物模型
造模方法:将老年小鼠置于水池中的倒置花盆平台(直径62.5px)上,该花盆被充满水的树脂玻璃室包围,可自由获取食物和水。水温保持在30±1℃。其中水位仅为表面下75px。时间为48~72h。
造模方法图如下:

模型评价:
1. Morris水迷宫试验检测小鼠学习记忆能力
2. 伊文思蓝检测血脑屏障通透性
同时,云克隆开发了上述研究中涉及到的相关靶标产品,靶标及核心货号如下,供参考: